题目内容
20.向一定量AgNO3和Cu (NO3)2混合溶液中加入一定量的锌粉,充分反应后过滤,得滤液A和滤渣B,滤液A中所含溶质不可能的情况是( )| A. | Zn (NO3)2、AgNO3 | B. | Zn (NO3)2、Cu (NO3)2、AgNO3 | ||
| C. | Zn (NO3)2、Cu (NO3)2、 | D. | Zn (NO3)2 |
分析 锌比铜活泼,铜比银活泼,向一定量AgNO3和Cu (NO3)2混合溶液中加入一定量的锌粉,锌先和硝酸银反应生成硝酸锌和银,如果锌反应后有剩余,再和硝酸铜反应生成硝酸锌和铜.
解答 解:A、锌先和硝酸银反应生成硝酸锌和银,因此滤液中一定含有硝酸锌,当滤液中含有硝酸银时说明锌不足以和硝酸银反应,则硝酸铜没有反应,因此如果滤液中含有硝酸银,则一定含有硝酸铜,该选项说法不正确;
B、当锌不足以和硝酸银反应时,滤液中含有反应生成的硝酸锌,没有反应的硝酸银和没有反应的硝酸铜,该选项说法正确;
C、当锌恰好和硝酸银完全反应时,滤液中含有硝酸锌和硝酸铜,该选项说法正确;
D、当锌恰好和硝酸银、硝酸铜完全反应时,或锌过量时,滤液中只含有硝酸锌,该选项说法正确.
故选:A.
点评 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.目前使用的燃料大多来自化石燃料.
(1)写出天然气中甲烷完全燃烧的化学方程式CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.
(2)分析下表,与煤相比,用天然气作燃料的优点有等质量的天然气和煤完全燃烧,天然气燃烧产生二氧化碳的质量少于煤,放出的热量多于煤.
(3)为提高煤的利用率,可将其转化为可燃性气体,该反应的微观示意图如下,则生成物的分子个数比为1:1.

(1)写出天然气中甲烷完全燃烧的化学方程式CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.
(2)分析下表,与煤相比,用天然气作燃料的优点有等质量的天然气和煤完全燃烧,天然气燃烧产生二氧化碳的质量少于煤,放出的热量多于煤.
| 1g物质完全燃烧 | ||
| 产生二氧化碳的质量/g | 放出的热量/kJ | |
| 甲烷 | 2.75 | 56 |
| 煤碳 | 3.67 | 32 |

8.李克强总理在十二届全国人大五次会议所作的政府工作报告中指出:今年二氧化硫(SO2)、氮氧化物的排放分别要下降3%.下列有关二氧化硫的说法中错误的是( )
| A. | 二氧化硫中硫元素的化合价为+4价 | |
| B. | 二氧化硫是导致酸雨的主要气体之一 | |
| C. | 二氧化硫中硫元素与氧元素的质量比为1:2 | |
| D. | 二氧化硫是无色有刺激性气味的气体 |
15.除去二氧化碳气体中混有的少量的一氧化碳,最合理的方法是( )
| A. | 点燃混合气体 | B. | 把混合气体通过氢氧化钠溶液中 | ||
| C. | 使混合气体通过灼热的氧化铜 | D. | 使混合气体通过灼热的焦炭 |
5.小明同学在总结酸碱盐之间的相互反应关系时发现,选用适当物质可以实现如图所示的所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )


| A. | HCl NaOH BaCl2 Na2SO4 | B. | HCl Ba(OH)2 Na2SO4 BaCl2 | ||
| C. | H2SO4Ba(OH)2 Na2SO4 BaCl2 | D. | H2SO4 NaOH BaCl2 Na2SO4 |
9.如图所示实验操作中,正确的是( )
| A. |  取用固体粉末 | B. |  塞紧橡胶塞 | C. |  测溶液酸碱性 | D. |  过滤操作 |
10.下列实验操作正确的是( )
| A. |  稀释浓硫酸 | B. |  加热液体 | C. |  点燃酒精灯 | D. |  倾倒液体 |
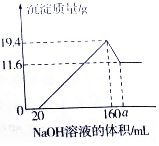 已知:Mg(OH)2是难溶性碱,不溶于碱性溶液;A1(OH)3也是难溶性碱,但它既可以与强酸反应,生成可溶性铝盐,也可以与强碱反应,生成可溶性偏铝酸盐,例如Al(OH)3+NaOH=NaAlO2(偏铝酸钠)+2H2O.现将一定质量的镁铝合金样品全部溶于100mL某浓度的盐酸溶液中,之后向所得溶液中滴加200g/L的NaOH溶液,生成沉淀质量与加入的NaOH溶液体积关系如图所示.
已知:Mg(OH)2是难溶性碱,不溶于碱性溶液;A1(OH)3也是难溶性碱,但它既可以与强酸反应,生成可溶性铝盐,也可以与强碱反应,生成可溶性偏铝酸盐,例如Al(OH)3+NaOH=NaAlO2(偏铝酸钠)+2H2O.现将一定质量的镁铝合金样品全部溶于100mL某浓度的盐酸溶液中,之后向所得溶液中滴加200g/L的NaOH溶液,生成沉淀质量与加入的NaOH溶液体积关系如图所示.