题目内容
4.现有氧化钙和碳酸钙的固体混合物,质量为100g,将其高温煅烧至碳酸钙完全分解,称得剩余固体的质量为84g,则原固体混合物中钙元素的质量分数为60%.分析 根据碳酸钙完全分解,则剩余固体为氧化钙,利用钙元素的质量守恒可知混合物中钙元素的质量,再计算原固体混合物中钙元素的质量分数.
解答 解:因反应后得到的固体物质是纯净的CaO,
由高温煅烧过程中钙元素的质量不发生变化,
则CaO中钙元素的质量就是原混合物中钙元素的质量,
CaO中钙元素的质量为84g×$\frac{40}{40+16}$×100%=60g,
又氧化钙和碳酸钙的固体混合物质量为100g,
则原固体混合物中钙元素的质量分数是$\frac{60g}{100g}$×100%=60%,
故答案为:60%.
点评 本题考查元素的质量分数计算,学生利用碳酸钙完全分解后固体为氧化钙,再利用钙元素的质量守恒来推断混合物中钙元素的质量是解答的关键.

练习册系列答案
相关题目
14.如图是甲、乙、丙三种物质的溶解度曲线,下列分析不正确的是( )


| A. | t2℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是甲>乙>丙 | |
| B. | t2℃时,将50g甲物质放入100g水中充分溶解得到甲的饱和溶液 | |
| C. | 将t2℃时,三种物质的饱和溶液降温 至t1℃,所得溶液的溶质质量分数关 系是乙>甲=丙 | |
| D. | 将丙的饱和溶液变为不饱和溶液,可采用降温的方法 |
15.除去二氧化碳气体中混有的少量的一氧化碳,最合理的方法是( )
| A. | 点燃混合气体 | B. | 把混合气体通过氢氧化钠溶液中 | ||
| C. | 使混合气体通过灼热的氧化铜 | D. | 使混合气体通过灼热的焦炭 |
19.某些金属氢化物与水反应可生成碱和氢气,如:RH+H2O═ROH+H2↑.则CaH2与足量K2CO3溶液之间发生反应的产物有( )
| A. | Ca(OH)2和H2 | B. | KOH和Ca(OH)2 | C. | CaCO3、KOH和H2 | D. | Ca(OH)2、CaCO3和H2 |
9.如图所示实验操作中,正确的是( )
| A. |  取用固体粉末 | B. |  塞紧橡胶塞 | C. |  测溶液酸碱性 | D. |  过滤操作 |
16.下列叙述不正确的是( )
| A. | 用互相刻画的方法,可比较硬铝和铝的硬度 | |
| B. | 用灼烧闻气味的方法,可区分棉纤维和蚕丝 | |
| C. | 加热石灰粉末研磨,可鉴别硫酸铵和尿素 | |
| D. | 用滴加无色酚酞试液的方法,鉴别NaOH溶液和Na2CO3溶液 |
13.下列化学方程式符合客观事实的是( )
| A. | 2NaOH+H2SO4═Na2SO2+2H2↑+O2↑ | B. | 2Ag+2HCl═2AgCl↓+H2↑ | ||
| C. | 6HCl+Fe2O3═3H2O+2FeCl3 | D. | 3KCl+Al(NO3)3═3KNO3+AlCl3 |
14.下列实验方法一定能达到实验目的是( )
| 选项 | 实验目的 | 实验方法 |
| A | 除去粗盐中的难溶性杂质 | 将粗盐研碎、溶解、蒸发 |
| B | 除去铁制品上的铁锈 | 将铁制品长时间浸泡在足量的稀硫酸中 |
| C | 鉴别石灰水和NaOH溶液 | 加入适量的稀盐酸 |
| D | 检验某矿石中是否含碳酸盐 | 加入适量的稀盐酸,若产生气体再将气体通入澄清石灰水 |
| A. | A | B. | B | C. | C | D. | D |
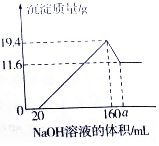 已知:Mg(OH)2是难溶性碱,不溶于碱性溶液;A1(OH)3也是难溶性碱,但它既可以与强酸反应,生成可溶性铝盐,也可以与强碱反应,生成可溶性偏铝酸盐,例如Al(OH)3+NaOH=NaAlO2(偏铝酸钠)+2H2O.现将一定质量的镁铝合金样品全部溶于100mL某浓度的盐酸溶液中,之后向所得溶液中滴加200g/L的NaOH溶液,生成沉淀质量与加入的NaOH溶液体积关系如图所示.
已知:Mg(OH)2是难溶性碱,不溶于碱性溶液;A1(OH)3也是难溶性碱,但它既可以与强酸反应,生成可溶性铝盐,也可以与强碱反应,生成可溶性偏铝酸盐,例如Al(OH)3+NaOH=NaAlO2(偏铝酸钠)+2H2O.现将一定质量的镁铝合金样品全部溶于100mL某浓度的盐酸溶液中,之后向所得溶液中滴加200g/L的NaOH溶液,生成沉淀质量与加入的NaOH溶液体积关系如图所示.