题目内容
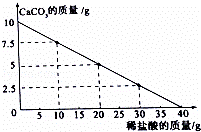
向10g CaCO3中不断加入稀盐酸,其质量变化如图所示,请回答下列问题:
(1)当10gCaCO3恰好完全反应时,所加稀盐酸的质量为 g.
(2)所加稀盐酸的溶质质量分数为多少?(写出计算过程,结果精确到0.01%)
考点:
根据化学反应方程式的计算;有关溶质质量分数的简单计算.
专题:
综合计算(图像型、表格型、情景型计算题).
分析:
(1)由图象可知:当CaCO3质量为0时,即为盐酸与CaCO3恰好完全反应的时刻,此时所用稀盐酸的量即是所消耗的稀盐酸,故10g CaCO3完全反应时,所加稀盐酸的质量为40g.
(2)根据碳酸钙与盐酸反应的化学方程式,由碳酸钙的质量可以计算出消耗的稀盐酸的溶质质量,由溶质质量分数计算公式即可求出稀盐酸的溶质质量分数.
解答:
解:(1)如图象所示:当10gCaCO3恰好完全反应时,所加稀盐酸的质量40g;
(2)解:设40g稀盐酸含有HCl的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
10g x
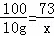
X=7.3g
所加稀盐酸的溶质质量分数为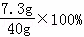 =18.25%
=18.25%
故答案为:
(1)40g
(2)所加稀盐酸的溶质质量分数为18.25%
点评:
据化学方程式可以表示反应中各物质的质量关系,由其中任意一种物质的质量可计算反应中其它物质的质量.

 名校课堂系列答案
名校课堂系列答案烧杯中有一定质量的MgO和MgCO3的混合物,向其中加入150g稀盐酸,恰好完全反应,一定温度下,得到156g不饱和溶液.下列数据中,与该溶液的溶质质量分数最接近的是( )
|
| A. | 16.6% | B. | 6.1% | C. | 12.2% | D. | 9.1% |
铝合金的生产与销售是潍坊市一条重要的产业链,为测定某种铝铜合金中铝的质量分数,探究小组进行了如下实验:
| 实验编号 | 铝铜合金的质量(g) | 加入稀硫酸的质量(g) | 生成H2的质量(g) |
| 实验1 | 30 | 392 | 2 |
| 实验2 | 30 | 588 | 3 |
| 实验3 | 30 | 600 | 3 |
(1)所用稀硫酸溶质的质量分数为 .
(2)该铝铜合金中铝的质量分数是多少?
农业生产需要合理使用各类肥料.下列化肥属于磷肥的是( )
|
| A. | NH4Cl | B. | K2SO4 | C. | KNO3 | D. | Ca(H2PO4)2 |

 硫酸
硫酸