题目内容
铝合金的生产与销售是潍坊市一条重要的产业链,为测定某种铝铜合金中铝的质量分数,探究小组进行了如下实验:
| 实验编号 | 铝铜合金的质量(g) | 加入稀硫酸的质量(g) | 生成H2的质量(g) |
| 实验1 | 30 | 392 | 2 |
| 实验2 | 30 | 588 | 3 |
| 实验3 | 30 | 600 | 3 |
(1)所用稀硫酸溶质的质量分数为 .
(2)该铝铜合金中铝的质量分数是多少?
考点:
根据化学反应方程式的计算;有关溶质质量分数的简单计算.
专题:
综合计算(图像型、表格型、情景型计算题).
分析:
加入392g稀硫酸时,生成氢气的质量是2g,加入588g稀硫酸时,生成氢气的质量是3g,继续加入稀硫酸时不再产生氢气,说明588g稀硫酸和铝恰好反应生成3g氢气,根据氢气的质量可以计算硫酸和铝的质量,进一步可以计算所用稀硫酸溶质的质量分数和该铝铜合金中铝的质量分数.
解答:
解:(1)设铝的质量为x,588g稀硫酸中硫酸的质量为y,
2Al+3H2SO4═Al2(SO4)3+3H2↑,
54 294 6
x y 3g
 =
= =
= ,
,
x=27g,y=147g,
所用稀硫酸溶质的质量分数为: ×100%=25%,
×100%=25%,
故填:25%.
(2)该铝铜合金中铝的质量分数为: ×100%=90%,
×100%=90%,
答:该铝铜合金中铝的质量分数为90%.
点评:
铜不能和稀硫酸反应,铝和稀硫酸反应生成硫酸铝和氢气,因此过程中产生的氢气都是由铝和稀硫酸反应生成的.

现有10.6g碳酸钠和8.4g碳酸氢钠,分别与过量盐酸反应,其中( )
|
| A. | 碳酸钠消耗的氯化氢多 | B. | 碳酸氢钠生成的二氧化碳多 |
|
| C. | 碳酸氢钠消耗的氯化氢多 | D. | 碳酸氢钠生成的二氧化碳多 |
下图1是a、b、c三种固体物质的溶解度曲线,图2表示三种固体的饱和溶液在t3℃时蒸发等量的水,析出晶体的情形。
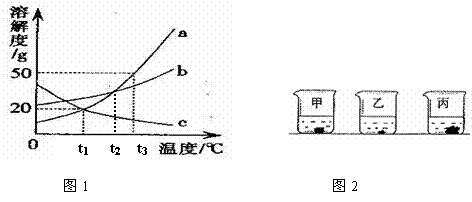 |
(1)图中  物质的溶解度与气体物质溶解度受温度影响变化趋势相似。
物质的溶解度与气体物质溶解度受温度影响变化趋势相似。
(2)乙烧杯中对应的溶质是 (填“a”或“b”或“c”)
(3)将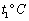 时a、b、c的饱和溶液各100 g分别升温到
时a、b、c的饱和溶液各100 g分别升温到 。若不考虑水分蒸发,下列说法正确的是 (填字母代号,下同)
。若不考虑水分蒸发,下列说法正确的是 (填字母代号,下同)
A. a、b变为不饱和溶液,c仍为饱和溶液
B. a、b两溶液溶质质量分数相等
C. a、b两溶液的质量相等
D. 溶液c中的溶 剂质量最少
剂质量最少
(4)通常情况下,在实验室用6%的a溶液配制1%的a溶液,需要到的仪器有:烧杯、 (填字母代号)。
A. 托盘天平(带砝码盒) B. 药匙 C. 玻璃棒
D. 漏斗 E. 铁架台 F. 量筒 G. 胶头滴管
 以下是实验室制取氧气的装置图,请按要求回答下列问题.
以下是实验室制取氧气的装置图,请按要求回答下列问题.

 二氧化碳,还需要的药品是_ __,选择的发生装置是_ __(填序号),收集装置是__(填序号),验满的方法是_ __。
二氧化碳,还需要的药品是_ __,选择的发生装置是_ __(填序号),收集装置是__(填序号),验满的方法是_ __。
 2AlN+3CO.若有14kg的氮气参加反应,可生成氮化铝的质量为多少?
2AlN+3CO.若有14kg的氮气参加反应,可生成氮化铝的质量为多少?