题目内容
某样品由氧化铜和铜.取10.0g该样品于烧杯中,向其中加入192.0某浓度的稀硫酸,恰好完全反应,最终所得溶液质量为200.0g.(已知:CuO+H2SO4=CuSO4+H2O)
(1)所取样品中含铜元素的质量为 g.
(2)计算最终所得溶液中溶质的质量分数.(请写出计算过程)
考点:
根据化学反应方程式的计算;有关溶质质量分数的简单计算.
专题:
溶质质量分数与化学方程式相结合的计算.
分析:
氧化铜能与稀硫酸反应生成硫酸铜和水,铜不与稀硫酸反应;由最终所得溶液的质量可以求出氧化铜的质量,从而求出铜元素的质量,根据反应的化学方程式,计算出生成硫酸铜的质量,进而可计算出反应后所得溶液中溶质的质量分数.
解答:
解:(1)氧化铜的质量为:200.0g﹣192.0g=8g,故铜元素质量2g+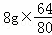 =8.4g,故填:8.4;
=8.4g,故填:8.4;
(2)生成硫酸铜的质量为x,
CuO+H2SO4═CuSO4+H2O
80 160
8g x
 x=16g
x=16g
最终所得溶液中溶质的质量分数=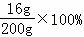 =8%.
=8%.
答:最终所得溶液中溶质的质量分数为8%.
点评:
本题难度不大,掌握利用化学方程式与溶质质量分数的综合计算即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
区分下列各组物质的两种方法都合理的是 ( )
( )
| A | B | C | D | |
| 需区分 | ||||
| 的物质 | 锦纶和 | |||
| 羊毛 | 黄铜和 | |||
| 焊锡 | 人体吸入的 | |||
| 空气和呼出 | ||||
| 的气体 | 厕所清洁剂 | |||
| (含HCl)和炉具 | ||||
| 清洁剂(含NaOH) | ||||
| 方 | 观察 | |||
| 颜色 | 加入硫酸 | |||
| 镁溶液 | 加入 | |||
| 的石灰水 | 加入酚 | |||
| 酞溶液 | ||||
| 方法二 | 点燃,观 | |||
| 察灰烬 | 比较 | |||
| 硬度 | 观察颜色 | 加入小苏打 |
下列物质可用作磷肥的是( )
|
| A. | 尿素 | B. | 硝酸钠 | C. | 磷矿粉 | D. | 硫酸钾 |
 析正确的个数有( )
析正确的个数有( ) 得到的固体可能有Ag、Cu、Al
得到的固体可能有Ag、Cu、Al 法一
法一