题目内容
15.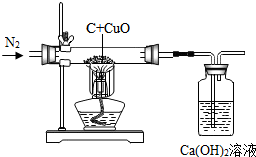 碳还原氧化铜的实验中,当温度不够高时,可能生成红色的氧化亚铜(Cu2O),氧化亚铜与稀硫酸反应生成硫酸铜、铜和水.用下图的装置验证碳的还原性(碳过量),实验前先通一段时间氮气,然后关闭弹簧夹,点燃酒精
碳还原氧化铜的实验中,当温度不够高时,可能生成红色的氧化亚铜(Cu2O),氧化亚铜与稀硫酸反应生成硫酸铜、铜和水.用下图的装置验证碳的还原性(碳过量),实验前先通一段时间氮气,然后关闭弹簧夹,点燃酒精灯加热,完全反应后,打开弹簧夹,继续通氮气同时熄灭酒精灯至装置冷却.下列说法正确的是( )
| A. | 先通氮气主要是防止玻璃管内气体不纯,加热时发生爆炸 | |
| B. | 固体减少的质量等于生成的二氧化碳的质量 | |
| C. | 反应后所得红色固体都是铜 | |
| D. | 将反应后的固体加入足量的稀硫酸,观察到溶液变蓝色烧杯底有红色和黑色固体,说明实验过程中有氧化亚铜生成 |
分析 A、根据先通氮气主要是排净空气,避免空气中二氧化碳的干扰解答;
B、根据固体减少的质量等于氧化铜中氧元素的质量解答;
C、根据碳还原氧化铜的实验中,当温度不够高时,可能生成红色的氧化亚铜(Cu2O)解答;
D、根据氧化亚铜与稀硫酸反应生成硫酸铜、铜和水解答.
解答 解:A、先通氮气主要是排净空气,避免空气中二氧化碳的干扰,故错误;
B、碳和氧化铜反应生成铜和二氧化碳,固体减少的质量等于氧化铜中氧元素的质量,故错误;
C、碳还原氧化铜的实验中,当温度不够高时,可能生成红色的氧化亚铜(Cu2O),所得红色固体不一定都是铜,故错误;
D、氧化亚铜与稀硫酸反应生成硫酸铜、铜和水,将反应后的固体加入足量的稀硫酸,观察到溶液变蓝色烧杯底有红色和黑色固体,说明实验过程中有氧化亚铜生成,故正确.
答案:D
点评 实验过程中需要注意的问题很多,要对各种实验有一个比较全面的理解,为设计实验、进行实验、分析实验奠定基础.

练习册系列答案
相关题目
3.下列依据实验目的所设计的实验操作中,正确的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 检验某气体是否为CO2 | 将燃着的木条伸入气体中 |
| B | 鉴别NaCl溶液和稀盐酸 | 滴加无色酚酞溶液 |
| C | 除去CaCO3中的Na2CO3 | 加水溶解,过滤 |
| D | 除去CO2中的CO | 点燃 |
| A. | A | B. | B | C. | C | D. | D |
10.化学与我们的生产、生活息息相关,以下说法中,不合理的是( )
| A. | 工业常用铁桶来储运烧碱 | |
| B. | 冬天室内用煤炉取暖要严防煤气中毒,可多撒石灰水避免 | |
| C. | 蒸馏水是纯净物,没有味道 | |
| D. | 将菜刀泡在水中可少生锈 |
20.小亮在做“盐酸中和氢氧化钠溶液”的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度.于是他对所得溶液的酸碱性进行探究.
【提出猜想】所得溶液可能呈碱性,也可能呈中性或酸性
【实验探究】
【拓展分析】若溶液呈碱性,他向溶液中逐渐加入硫酸铜溶液,直至不再产生沉淀为止,然后过滤,留在滤纸上的物质Cu(OH)2(写化学式,下同),滤液中一定含有的溶质是NaCl、Na2SO4.
【提出猜想】所得溶液可能呈碱性,也可能呈中性或酸性
【实验探究】
| 实验操作 | 实验现象 | 结论 |
| 用试管取该溶液1-2mL,滴入1-2滴无色酚酞试液,振荡 | 无色酚酞试液不变色 | 溶液呈中性或酸性 |
7.为了除去下表物质中的杂质(括号内为杂质),所选试剂(过量)及操作方法均正确的是( )
| 物 质 | 选用试剂(过量) | 操作方法 | |
| A | N2(O2) | 铜粉 | 气体通过炽热的铜粉 |
| B | CO2(HCl) | 氢氧化钠溶液 | 气体通过盛有氢氧化钠溶液的洗气瓶 |
| C | Cu(CuO) | 氧气 | 通入氧气并加热 |
| D | NaCl溶液(Na2CO3) | 氯化钙溶液 | 加入氯化钙溶液充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
4.下列实验操作正确的是( )
| A. |  验证反应放热 | B. |  过滤 | ||
| C. |  稀释浓硫酸 | D. |  验满 |
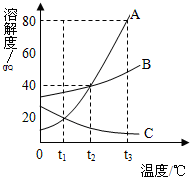 如图是 A、B、C三种物质的溶解度曲线,回答下列问题:
如图是 A、B、C三种物质的溶解度曲线,回答下列问题:

