题目内容
5.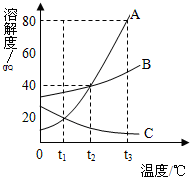 如图是 A、B、C三种物质的溶解度曲线,回答下列问题:
如图是 A、B、C三种物质的溶解度曲线,回答下列问题:(1)如果A物质中混有少量B物质,可用降温结晶的方法得到较纯的A物质;
(2)在t2℃时,将200gB物质的饱和溶液蒸发10g水,可析出晶体B(不含结晶水)4g;
(3)将t3℃时A、B、C饱和溶液降温到t2℃,溶液溶质质量分数的大小关系为A=B>C;
(4)在t2℃时,向50克的水中加入25克A物质,充分溶解后所得的溶液为饱和溶液(填“饱和溶液”或“不饱和溶液”),形成溶液的溶质质量分数28.6%.
分析 (1)根据A物质的溶解度受温度的影响变化较大进行解答;
(2)根据t2℃时,B物质的溶解度为40g进行解答;
(3)根据物质的溶解度随温度变化情况及饱和溶液中溶质的质量分数分析解答;
(4)根据该温度下A的溶解度分析判断,并据溶质的质量分数计算式解答.
解答 解:(1)A物质的溶解度受温度的影响变化较大,所以如果A物质中混有少量B物质,可用降温结晶的方法得到较纯的A物质;故填:降温结晶;
(2)t2℃时,B物质的溶解度为40g,即t2℃时100g水中溶解40gB物质达到饱和,所以在t2℃时,将200gB物质的饱和溶液蒸发10g水,可析出晶体B(不含结晶水)4g;故填:4;
(3)AB的溶解度随温度降低而减小,C的溶解度随温度降低而增大,所以将t3℃时A、B、C三种物质的饱和溶液降温至t2℃时,AB析出晶体,溶质的质量分数减小,C的溶解度变大,溶质、溶剂的质量不变,所以溶质的质量分数与降温前相等;饱和溶液中溶质的质量分数的计算式$\frac{溶解度}{溶解度+100g}$×100%,可知溶解度大则溶质的质量分数大,而t2℃时B的溶解度等于A的溶解度大于t3℃时C的溶解度,所以此时A、B、C三种物质的溶液的溶质质量分数大小关系是A=B>C;故填:A=B>C;
(4)t3℃时A的溶解度是40g,即100g水中最多溶解A 的质量是40g,所以A物质25g放入50g水中,最多溶解20g,所得溶液是饱和溶液;溶质的质量分数是:$\frac{20g}{20g+50g}$×100%≈28.6%.故填:28.6%.
点评 主要考查了固体溶解度曲线的意义及温度对固体溶解度的影响,培养学生应用知识解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.如图是某反应的微观示意图,下列说法不正确的是( )
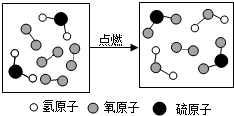

| A. | 反应物中有单质(S-32;H-1;O-16) | B. | 该反应为置换反应 | ||
| C. | 生成物的分子个数比为1:1 | D. | 参加反应的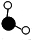 和 和 的质量比为17:24 的质量比为17:24 |
14.下列物质充争混合后遇火,可能发生爆炸的是( )
| A. | 氧气和氮气 | B. | 硫粉和氧气 | C. | 二氧化碳和氧气 | D. | 一氧化碳和氢气 |
15.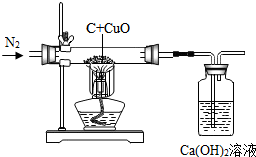 碳还原氧化铜的实验中,当温度不够高时,可能生成红色的氧化亚铜(Cu2O),氧化亚铜与稀硫酸反应生成硫酸铜、铜和水.用下图的装置验证碳的还原性(碳过量),实验前先通一段时间氮气,然后关闭弹簧夹,点燃酒精
碳还原氧化铜的实验中,当温度不够高时,可能生成红色的氧化亚铜(Cu2O),氧化亚铜与稀硫酸反应生成硫酸铜、铜和水.用下图的装置验证碳的还原性(碳过量),实验前先通一段时间氮气,然后关闭弹簧夹,点燃酒精
灯加热,完全反应后,打开弹簧夹,继续通氮气同时熄灭酒精灯至装置冷却.下列说法正确的是( )
 碳还原氧化铜的实验中,当温度不够高时,可能生成红色的氧化亚铜(Cu2O),氧化亚铜与稀硫酸反应生成硫酸铜、铜和水.用下图的装置验证碳的还原性(碳过量),实验前先通一段时间氮气,然后关闭弹簧夹,点燃酒精
碳还原氧化铜的实验中,当温度不够高时,可能生成红色的氧化亚铜(Cu2O),氧化亚铜与稀硫酸反应生成硫酸铜、铜和水.用下图的装置验证碳的还原性(碳过量),实验前先通一段时间氮气,然后关闭弹簧夹,点燃酒精灯加热,完全反应后,打开弹簧夹,继续通氮气同时熄灭酒精灯至装置冷却.下列说法正确的是( )
| A. | 先通氮气主要是防止玻璃管内气体不纯,加热时发生爆炸 | |
| B. | 固体减少的质量等于生成的二氧化碳的质量 | |
| C. | 反应后所得红色固体都是铜 | |
| D. | 将反应后的固体加入足量的稀硫酸,观察到溶液变蓝色烧杯底有红色和黑色固体,说明实验过程中有氧化亚铜生成 |
 某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3以外的物质都不与稀硫酸反应).兴趣小组的同学称取40g废铁锅片放入特制容器中,缓慢加入稀硫酸,直到反应完全(假设硫酸先与表面的铁锈发生反应),实验数据如图所示.
某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3以外的物质都不与稀硫酸反应).兴趣小组的同学称取40g废铁锅片放入特制容器中,缓慢加入稀硫酸,直到反应完全(假设硫酸先与表面的铁锈发生反应),实验数据如图所示.

 如图是碘元素在元素周期表中的信息图及两种微粒的结构示意图.
如图是碘元素在元素周期表中的信息图及两种微粒的结构示意图.