题目内容
13.“NaC1+CO2+NH3+H2O=NaHCO3+NH4Cl”是氨碱法制纯碱中的重要反应.下列叙述正确的是( )| A. | 该条件下NaHCO3的溶解度比NH4C1的大 | |
| B. | 析出晶体后的溶液为NaHCO3的不饱和溶液 | |
| C. | 在加压的条件下向饱和氨盐水中通二氧化碳,能加速NaHCO3的生成 | |
| D. | 析出晶体后剩余溶液中只有一种溶质 |
分析 相同条件下,物质的溶解度越小,越容易从溶液中析出;
条件不变时,析出晶体后的溶液仍然是该物质的饱和溶液;
压强越大,气体的溶解度越大;
析出晶体后的溶质有碳酸氢钠和氯化铵.
解答 解:A、该条件下NaHCO3的溶解度比NH4C1的小,先从溶液中析出,该选项说法不正确;
B、析出晶体后的溶液仍然为NaHCO3的饱和溶液,该选项说法不正确;
C、在加压的条件下,能够增大二氧化碳的溶解度,此时向饱和氨盐水中通二氧化碳,能加速NaHCO3的生成,该选项说法正确;
D、析出晶体后的溶质有碳酸氢钠和氯化铵,该选项说法不正确.
故选:C.
点评 条件不变时,析出晶体后的溶液仍然是该物质的饱和溶液,如果是不饱和溶液,析出的晶体又能够向溶液中溶解了,要注意理解.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.在装有水的四个烧杯中,分别加入少量泥巴、食盐、菜油和面粉,充分搅拌后可形成溶液的是( )
| A. | 泥巴 | B. | 食盐 | C. | 菜油 | D. | 面粉 |
1.下列关于碳和碳的氧化物的说法,不正确的是( )
| A. | 金刚石、石墨和C60都是碳元素的单质 | |
| B. | CO和CO2的化学性质差异很大,是因为分子的构成不同 | |
| C. | CO和CO2都有毒性 | |
| D. | CO2不能燃烧,也不支持燃烧,且密度大于空气,故CO2可以灭火 |
18.在①碳循环②氧循环③水的天然循环三种循环过程中所发生的变化一定不需要原子重新组合就能实现的是( )
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③ |
5.用化学用语填空:
(1)2个一氧化碳分子:2CO;
(2)2个亚铁离子:2Fe2+;
(3)碳酸镁中碳酸根为-2价Mg$\stackrel{-2}{C{O}_{3}}$;
(4)纯碱的化学式Na2CO3.
(1)2个一氧化碳分子:2CO;
(2)2个亚铁离子:2Fe2+;
(3)碳酸镁中碳酸根为-2价Mg$\stackrel{-2}{C{O}_{3}}$;
(4)纯碱的化学式Na2CO3.
2.下列有关物质的鉴别方案正确的一组是( )
| A. | 利用组内试剂即可鉴别氯化镁溶液、氢氧化钠溶液、硫酸溶液和硫酸铜溶液 | |
| B. | 可用燃着的火柴鉴别氮气、氧气和二氧化碳 | |
| C. | 可用氢氧化钡溶液鉴别碳酸铵、硫酸铵和硝酸铵 | |
| D. | 用一种试剂无法鉴别氧化铜粉末、炭粉和铁粉 |
 在生活与学习中,一些青少年学生由于长时间玩手机、用电脑或看书写字姿势不科学等行为,很容易造成眼睛近视,就会配戴类似如图所示的近视眼镜.
在生活与学习中,一些青少年学生由于长时间玩手机、用电脑或看书写字姿势不科学等行为,很容易造成眼睛近视,就会配戴类似如图所示的近视眼镜.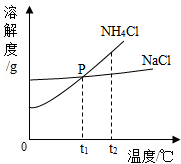 工业上采用氨碱法生产纯碱(Na2CO3),主要流程:
工业上采用氨碱法生产纯碱(Na2CO3),主要流程: