题目内容
5.为了测定某石灰石样品的组成,某化学兴趣小组的同学进行了以下实验,取四份相同质量的样品分别放入四个等质量的烧杯中,然后分别加入稀盐酸(杂质不与盐酸反应),充分反应后用天平称量,记录实验数据如下:| 试验次序 | 第1次 | 第2次 | 第3次 | 第4次 |
| 所取样品的质量/g | 25.0 | 25.0 | 25.0 | 25.0 |
| 加入稀盐酸的质量/g | 50.0 | 100.0 | 150.0 | 200.0 |
| 反应后烧杯中物质的总质量/g | 72.5 | 120.0 | 167.5 | 216.2 |
(1)经分析,在第1次实验结束后,反应物稀盐酸完全反应完了.
(2)25.0g样品与足量稀盐酸反应最多能生成气体8.8g.
(3)计算样品中碳酸钙的质量分数(写出具体计算过程).
(4)请在图中画出加入稀盐酸的质量与生成气体的质量的变化关系(标注必要的数值).

分析 有题目给出的信息可知:第1次加入50.0g盐酸,生成二氧化碳气体的质量为25.0g+50.0g-72.5g=2.5g、第2次加入 100.0g盐酸,生成二氧化碳气体的质量为25.0g+100.0g-120.0g=5.0g,说明每消耗50.0g盐酸生成二氧化碳气体的质量为2.5g,第3次加入 150.0g盐酸,生成二氧化碳气体的质量为25.0g+150.0g-167.5g=7.5g,第3次加入 200.0g盐酸,生成二氧化碳气体的质量为25.0g+200.0g-216.2g=8.8g,说明第1、2、3次盐酸完全反应,第4次酸有剩余,碳酸钙全部反应.
解答  解:(1)有题目给出的信息可知:第1次加入50.0g盐酸,生成二氧化碳气体的质量为25.0g+50.0g-72.5g=2.5g、第2次加入 100.0g盐酸,生成二氧化碳气体的质量为25.0g+100.0g-120.0g=5.0g,说明每消耗50.0g盐酸生成二氧化碳气体的质量为2.5g,第3次加入 150.0g盐酸,生成二氧化碳气体的质量为25.0g+150.0g-167.5g=7.5g,第3次加入 200.0g盐酸,生成二氧化碳气体的质量为25.0g+200.0g-216.2g=8.8g,说明第1、2、3次盐酸完全反应,第4次酸有剩余,碳酸钙全部反应.故答案为:稀盐酸;
解:(1)有题目给出的信息可知:第1次加入50.0g盐酸,生成二氧化碳气体的质量为25.0g+50.0g-72.5g=2.5g、第2次加入 100.0g盐酸,生成二氧化碳气体的质量为25.0g+100.0g-120.0g=5.0g,说明每消耗50.0g盐酸生成二氧化碳气体的质量为2.5g,第3次加入 150.0g盐酸,生成二氧化碳气体的质量为25.0g+150.0g-167.5g=7.5g,第3次加入 200.0g盐酸,生成二氧化碳气体的质量为25.0g+200.0g-216.2g=8.8g,说明第1、2、3次盐酸完全反应,第4次酸有剩余,碳酸钙全部反应.故答案为:稀盐酸;
(2)根据(1)中分析25.0g样品与足量稀盐酸反应最多能生成气体8.8g;故答案为:8.8;
(3)设25.0g样品中碳酸钙的质量为x,需要盐酸的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 8.8g
$\frac{100}{x}=\frac{44}{8.8g}$
x=20.0g
样品中碳酸钙的质量分数:$\frac{20.0g}{25.0g}$×100%=80.0%
答:样品中锌的质量分数为80.0%
(4)每消耗50.0g盐酸生成二氧化碳气体的质量为2.5g,设生成8.8g二氧化碳时需要盐酸的质量为y
$\frac{50.0g}{y}=\frac{2.5g}{8.8g}$
y=176g
所以加入稀盐酸的质量与生成气体的质量的变化关系图为:.
点评 本考点是有关化学方程式的计算题,属于表格型计算题.近几年的中考计算题,题型多样,主要有表格题、图象题、标签题、图象和表格相联系的综合题以及与文字叙述题等,从不同的方面考查了学生的识图能力、分析能力和计算能力.同学们要认真把握.

| A. | 垃圾分类处理 | B. | 使用一次性塑料餐盒 | ||
| C. | 乘坐公共交通工具 | D. | 将工业废弃处理后排放 |

| A. | 蜡烛燃烧前瓶内只有氧气 | |
| B. | 氧气浓度小于一定值时,蜡烛无法燃烧 | |
| C. | 过程中瓶内物质总质量不断减少 | |
| D. | 蜡烛熄灭后瓶内只剩二氧化碳气体 |
| A. | 可用过氧化氢的发生装置制取H2S气体 | |
| B. | 可用排水法收集H2S气体 | |
| C. | 可用向上排空气法收集H2S气体 | |
| D. | 可用水来吸收H2S气体防治污染空气 |
| A | 物质与结构 | B | 化学与环境 |
| 稀有气体是由原子直接构成 水分子-由氢原子和氧原子构成 氯化钾-由钾元素和氯元素组成 | 水净化程度最高-蒸馏 焚烧秸秆-增加土壤肥力,是有益的 化学实验室的废弃物-处理排放 | ||
| C | 化学与生活 | D | 化学与健康 |
| 硬水和软水-肥皂水 煤气和天然气-点燃看火焰颜色 简阳羊肉汤香气四溢-分子在运动 | 大量吸纯氧-有益身体健康 用干冰保存食物-防止受潮腐烂 为提高粮食产量-大量使用化肥农药 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 氧气助燃--切割金属 | |
| B. | 氢氧化钠固体易潮解--干燥某些气体 | |
| C. | 二氧化碳能与谁反应--人工降雨 | |
| D. | 盐酸能与金属氧化物反应--金属除锈 |

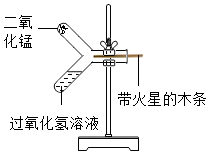 化学老师在和同学们探究二氧化锰的催化作用时,对教材实验进行了创新设计:
化学老师在和同学们探究二氧化锰的催化作用时,对教材实验进行了创新设计: