题目内容
2. 黄铜是铜锌合金,它可用来制造机器的零件等.某化学课外兴趣小组为测定某黄铜样品中铜的含量(不考虑样品中的杂质).(1)黄铜样品完全反应生成氢气的质量为0.1g
黄铜是铜锌合金,它可用来制造机器的零件等.某化学课外兴趣小组为测定某黄铜样品中铜的含量(不考虑样品中的杂质).(1)黄铜样品完全反应生成氢气的质量为0.1g(2)计算黄铜样品中铜的质量.(写出具体步骤)
分析 锌和稀硫酸反应生成硫酸锌和氢气,根据反应的化学方程式及其提供的数据可以进行相关方面的计算和判断.
解答 解:(1)由图中信息可知,黄铜样品完全反应生成氢气的质量为0.1g.
故填:0.1.
(2)设锌的质量为x,
Zn+H2SO4═ZnSO4+H2↑,
65 2
x 0.1g
$\frac{65}{x}$=$\frac{2}{0.1g}$,
x=3.25g,
黄铜样品中铜的质量为:10g-3.25g=6.75g,
答:黄铜样品中铜的质量为6.75g.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
5.向AgNO3溶液中加入一定质量的Fe和Al的混合粉末,充分反应后过滤,得到滤渣和浅绿色滤液.下列说法正确的是( )
| A. | 滤液中一定含有A13+、Ag+ | B. | 滤液中一定含有Fe2+、Ag+ | ||
| C. | 滤渣中一定含有Ag | D. | 滤渣中一定含有Fe |
13.下列实验现象和对应的结论描述都正确的是( )
| A. | 在某固体中滴加稀盐酸,有气泡产生--该固体一定是碳酸盐 | |
| B. | 在无色溶液中滴入无色酚酞试液,溶液变红--该溶液一定是碱溶液 | |
| C. | 生石灰块投入水中,水会沸腾--生石灰变成熟石灰的过程是放热反应 | |
| D. | 测定溶液的pH,先用水润湿pH试纸,然后将试纸插入待测液中 |
10.下列操作正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
11.化学试剂厂三个车间排放的废液中分别含有的溶质如下:
按照不同的方式处理,可以得到不同化学产品,从而充分利用资源,变废为宝.
(1)方案一,甲车间废液中加入适量的Na2CO3 溶液,可分离回收Ba(OH )2 和 NaOH,写出该反应的化学方程式Na2CO3+Ba(OH)2═BaCO3↓+2NaOH;
(2)方案二,乙、丙两车间的废液按适当比例混合后,可得到一种溶质为氯化钠的中性溶液;
(3)方案三,将三个车间的废液样品混合,过滤.得到无色溶液和白色沉淀.无色溶液中一定含有NaCl,为确定可能含有的溶质,设计下列实验,其中能达到目的是A
A. 若只加入MgSO4 溶液,能观察到明显现象
B. 若加入过量的Na2CO3 溶液后,再滴加石蕊溶液,都能观察到明显现象
C. 若加入过量的中性BaCl2 溶液后,再滴加酚酞溶液,都能观察到明显现象
(4)方案四,按照下列方式将三个车间的废液按适当比例混合(假设能反应的物质均恰好完全反应,且中间过程未过滤),最终只生成BaCO3 沉淀和NaCl 溶液的是B
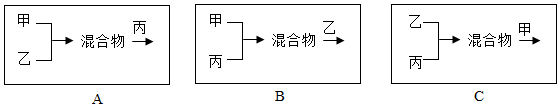 .
.
| 甲 | 乙 | 丙 |
| Ba(OH)2、NaOH | NaCl、Na2CO3 | HCl、NaCl |
(1)方案一,甲车间废液中加入适量的Na2CO3 溶液,可分离回收Ba(OH )2 和 NaOH,写出该反应的化学方程式Na2CO3+Ba(OH)2═BaCO3↓+2NaOH;
(2)方案二,乙、丙两车间的废液按适当比例混合后,可得到一种溶质为氯化钠的中性溶液;
(3)方案三,将三个车间的废液样品混合,过滤.得到无色溶液和白色沉淀.无色溶液中一定含有NaCl,为确定可能含有的溶质,设计下列实验,其中能达到目的是A
A. 若只加入MgSO4 溶液,能观察到明显现象
B. 若加入过量的Na2CO3 溶液后,再滴加石蕊溶液,都能观察到明显现象
C. 若加入过量的中性BaCl2 溶液后,再滴加酚酞溶液,都能观察到明显现象
(4)方案四,按照下列方式将三个车间的废液按适当比例混合(假设能反应的物质均恰好完全反应,且中间过程未过滤),最终只生成BaCO3 沉淀和NaCl 溶液的是B
 .
.  根据所学知识,完成下列填空:
根据所学知识,完成下列填空: