题目内容
6.如图是KCl和KNO3的溶解度曲线.下列说法正确的是( )
| A. | 温度高于t℃时,KCl的溶解度大于KNO3的溶解度 | |
| B. | 使KCl从溶液中结晶,多采用冷却热饱和溶液的方法 | |
| C. | 60℃的KNO3饱和溶液210g降温至40℃,能析出46g晶体 | |
| D. | 40℃时,KNO3饱和溶液的溶质质量分数为64% |
分析 A、由溶解度曲线:可以比较两物质的溶解度大小;
B、氯化钾溶解度受温度影响不大,所以时其从溶液中结晶析出,可采用蒸发结晶的方法;
C、据不同温度下硝酸钾的溶解度分析解答;
D、据饱和溶液中溶质的质量分数计算方法解答.
解答 解:A、从图中可以看出,温度高于t℃时,KCl的溶解度始终小于KNO3的溶解度,故错误;
B、氯化钾溶解度受温度影响不大,所以时其从溶液中结晶析出,可采用蒸发结晶的方法,故错误;
C、60℃的KNO3的溶解度是110g,即100g水中最多溶解110g的硝酸钾,形成饱和溶液的质量是210g,40℃时其溶解度变为64g,所以饱和溶液210g降温至40℃,析出晶体的质量是110g-64g=46g,正确;
D、饱和时质量分数=$\frac{溶解度}{溶解度+100g}$×100%,则40℃时,KNO3饱和溶液的溶质质量分数为$\frac{64g}{164g}$×100%<64%,故错误;
故选:C.
点评 本题难度不大,主要考查了固体溶解度曲线所表示的意义,通过本题可以加强学生对固体溶解度的理解,培养学生应用知识解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.某研究学习小组欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品16g,把80g稀盐酸分四次加入,实验过程所得数据如表(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应).根据实验数据计算:
(1)表中 n的数值为2.8.
(2)求盐酸中溶质的质量分数.(写出计算过程)
| 实验次数 | 1 | 2 | 3 | 4 |
| 加入稀盐酸的质量/g | 20 | 20 | 20 | 20 |
| 剩余固体的质量/g | 11 | 6 | 2.8 | n |
(2)求盐酸中溶质的质量分数.(写出计算过程)
15.如表是部分酸、碱和盐的溶解性表.据表回答下列问题
(1)根据表中所给的离子,写出一个有刺激性气体产生的化学方程式NH4NO3+NaOH═NaNO3+NH3↑+H2O
(2)由于盐酸具有挥发性,所以敞口放置的浓硫酸溶液中溶质的质量分数将减小(填增大,或减小)
(3)下列各组中的离子,能在溶液中大量共存的是C
A、Ba2+K+SO42-Cl-B、H+Ca2+OH-NO3-C、Mg2+NH4+NO3-Cl-D、Mg2+K+CO32-SO42-
(4)写出一种微溶物质的化学式CaSO4.
| OH- | NO3- | Cl- | SO42- | ||
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| NH4+ | 溶、挥 | 溶 | 溶 | 溶 | 溶 |
| K+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 |
| Ca2+ | 微 | 溶 | 溶 | 微 | 不 |
| Mg2+ | 不 | 溶 | 溶 | 溶 | 微 |
(2)由于盐酸具有挥发性,所以敞口放置的浓硫酸溶液中溶质的质量分数将减小(填增大,或减小)
(3)下列各组中的离子,能在溶液中大量共存的是C
A、Ba2+K+SO42-Cl-B、H+Ca2+OH-NO3-C、Mg2+NH4+NO3-Cl-D、Mg2+K+CO32-SO42-
(4)写出一种微溶物质的化学式CaSO4.
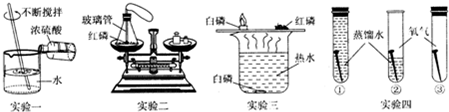

 屠呦呦曾从西晋医学家葛洪的《肘后备急方》中获得灵感,她因此认识到不能用加热法提取青蒿素;于是改用低沸点的乙醚提取,终于在经历第190次失败后获得成功,并荣获2015年诺贝尔生理学或医学奖.请回答:
屠呦呦曾从西晋医学家葛洪的《肘后备急方》中获得灵感,她因此认识到不能用加热法提取青蒿素;于是改用低沸点的乙醚提取,终于在经历第190次失败后获得成功,并荣获2015年诺贝尔生理学或医学奖.请回答: