题目内容
16.初中化学教材中的一些实验如图,请你回答下列问题.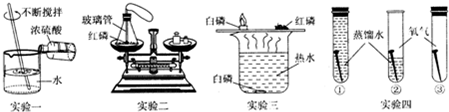
(1)实验一玻璃棒不断搅拌的目的是加速散热.
(2)实验二锥形瓶内发生化学反应的化学方程式是4P+5O2 $\frac{\underline{\;点燃\;}}{\;}$2P2O5;
(3)实验三依据铜片上的白磷燃烧而水中的白磷没燃烧的现象,得出可燃物燃烧需要氧气;
(4)实验四的目的是探究铁生锈的条件.
分析 (1)根据浓硫酸稀释时放热解答;
(2)根据反应物生成物正确书写化学方程式;
(3)通过实验对照分析;
(4)将铁钉置于不同的环境条件下,设置对照实验,探究铁生锈的条件.
解答 解:(1)浓硫酸稀释时放热,为防止液体飞溅,用玻璃棒搅拌,搅拌的目的是散热;
故填:加速散热;
(2)红磷燃烧生成五氧化二磷,该反应的化学方程式是4P+5O2 $\frac{\underline{\;点燃\;}}{\;}$2P2O5;
故填:4P+5O2 $\frac{\underline{\;点燃\;}}{\;}$2P2O5;
(3)图甲所示的实验中,铜片上的白磷能够燃烧是因为温度达到了白磷的着火点,并且与氧气接触,红磷不能燃烧是因为温度没有达到红磷的着火点,水中的白磷不能燃烧是因为没有与氧气接触.
故填:铜片上的白磷燃烧而水中的白磷没燃烧.
(4)将铁钉置于三中不同的环境中,观察铁钉是否生锈.
故填:探究铁生锈的条件.
点评 本题考查了燃烧条件、铁生锈的条件等的探究等,属于基础性的考查,难度不大,要求学生在平时的学习中要扎实基础.

练习册系列答案
相关题目
6.如图是甲、乙两位同学一起在实验室进行的氢氧化钠与盐酸中和反应的实验,根据图中实验,请你于甲、乙同学一起完成下列探究:


| 探究环节 | 甲同学的探究 | 乙同学的探究 |
| 提出问题 | A、溶液为什么不变红? | B、溶液中溶质是什么?(酚酞不计) |
| 做出猜想 | 实验过程中,酚酞变质了 | 猜想一:NaCl 猜想二:NaCl HCl |
| 实验验证 | (1)取少量A溶液与另一试管中,向其中滴加NaOH溶液,溶液变红,说明甲同学的猜想 不成立(选填“成立”或“不成立”)(2)A溶液未变红,你认为原因是A溶液中盐酸过量,加入的NaOH溶液未将其完全中和成恰好中和 | (3)为验证哪种猜想正确.下列物质可行的是ABCA、Mg B、CuO C、Cu(OH)2 D、AgNO3 |
| 交流反思 | (4)甲乙同学经实验对比探究,一致认为做化学实验时应注意药品用量的控制. | |
7.某同学制氧气时,试管炸裂了,造成试管炸裂的原因不可能是( )
| A. | 未给试管均匀预热 | |
| B. | 加热时试管与灯芯接触 | |
| C. | 加热前试管外壁沾有水珠 | |
| D. | 收集完氧气,先从水中取出导管再撤酒精灯 |
4.根据表中数据,回答下列问题.
(1)20℃时氯化钾的溶解度是34g;
(2)20℃时将25g硝酸钾与100g水混合,充分溶解后,所得溶液的溶质质量分数为20%;
(3)上表两种物质中,KNO3的溶解度受温度的影响大.
| 温度/℃ | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | KCl | 34.0 | 40.0 | 45.6 | 51.1 | 56.7 |
| KNO3 | 31.6 | 63.9 | 110 | 169 | 246 | |
(2)20℃时将25g硝酸钾与100g水混合,充分溶解后,所得溶液的溶质质量分数为20%;
(3)上表两种物质中,KNO3的溶解度受温度的影响大.
11.下列有关SO2的说法中,错误的是( )
| A. | 表示一个二氧化硫分子 | B. | 由硫和氧气两种物质组成 | ||
| C. | 两种元素质量比为1:1 | D. | 硫元素的化合价为+4 |
6.如图是KCl和KNO3的溶解度曲线.下列说法正确的是( )


| A. | 温度高于t℃时,KCl的溶解度大于KNO3的溶解度 | |
| B. | 使KCl从溶液中结晶,多采用冷却热饱和溶液的方法 | |
| C. | 60℃的KNO3饱和溶液210g降温至40℃,能析出46g晶体 | |
| D. | 40℃时,KNO3饱和溶液的溶质质量分数为64% |

 如图是KNO3和NaCl两种固体物质的溶解度曲线,请回答下列有关问题:
如图是KNO3和NaCl两种固体物质的溶解度曲线,请回答下列有关问题: