题目内容
16.某科学实验小组加热KClO3和MnO2的混合物15.5g制取氧气,完全反应后,称得固体剩余物质量为10.7g.化学方程式:2KClO3═2KCl+3O2↑(1)关于上述反应的说法,错误的是B(填字母序号).
A.MnO2做该反应的催化剂 B.MnO2的质量随着反应减少
C.MnO2加快KClO3的分解速率 D.MnO2的化学性质没有改变
(2)根据质量守恒定律,生成氧气的质量为4.8克.
(3)小组同学从剩余固体中提纯出KCl固体(提纯过程中药品无损失),欲将其配制成溶质质量分数为10%的KCl溶液,需加多少克水?
(4)取适量的KCl溶液于试管,滴入少量硝酸银溶液,出现白色沉淀,再滴入稀硝酸,沉淀不消失.说明KCl溶液中含有Cl-.写出KCl溶液与硝酸银溶液反应的化学方程式为KCl+AgNO3=AgCl↓+KNO3.
分析 (1)根据在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫做催化剂(又叫触媒),催化剂的特点可以概括为“一变二不变”,一变是能够改变化学反应速率,二不变是指质量和化学性质在化学反应前后保持不变;
(2)反应前后的质量差即为反应生成氧气的质量;
(3)根据氧气的质量可以计算氯化钾的质量,进一步可以计算配制成溶质质量分数为10%的KCl溶液,需加水的质量;
(4)根据KCl溶液与硝酸银溶液反应生成硝酸钾和氯化银解答.
解答 解:
(1)催化剂的特点可以概括为“一变二不变”,在此反应中,MnO2是催化剂,故在此反应前后,MnO2的质量和化学性质都不变.MnO2加快KClO3的分解速率;
(2)生成氧气的质量为:15.5g-10.7g=4.8g,
(3)设生成KCl的质量为x,
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,
149 96
x 4.8g
$\frac{149}{x}=\frac{96}{4.8g}$
x=7.45g,
KCl溶液的质量为:$\frac{7.45g}{10%}$=74.5g,
加水的质量为:74.5g-7.45g=67.05g,
(4)KCl溶液与硝酸银溶液反应的化学方程式为:KCl+AgNO3=AgCl↓+KNO3
答案:
(1)B;
(2)4.8;
(3)需加67.05g水.
(4)KCl+AgNO3=AgCl↓+KNO3
点评 解答本题的关键是利用差量法求出氧气的质量,只要求出氧气的质量,计算就可以展开,要注意理解.

练习册系列答案
相关题目
6.下列应用和相应原理(用化学方程式表示)及基本反应类型都正确的是( )
| A. | 用氢氧化钠溶液吸收二氧化碳:CO2+2NaOH═Na2CO3+H2O 复分解反应 | |
| B. | 溶洞的形成:CaCO3+H2O+CO2═Ca(HCO2)2 化合反应 | |
| C. | 实验室制取氢气:Fe+2HCl═FeCl2+H2 置换反应 | |
| D. | 用氢氧化镁治疗胃酸过多:Mg(OH)2+H2SO4═MgSO4+2H2O 中和反应 |
4.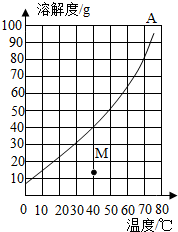 如图是A物质的溶解度曲线图,如表是B物质在不同温度时的溶解度.
如图是A物质的溶解度曲线图,如表是B物质在不同温度时的溶解度.
(1)请根据如表数据在图上绘制出B物质的溶解度曲线.
(2)40℃时,A、B两种物质的饱和溶液中溶质的质量分数相等.
(3)若要从A的溶液中提取A物质,小明同学认为要用蒸发溶剂水的方法;小娟同学认为要用冷却热饱和溶液结晶的方法.你认为小娟同学的方法合理.
(4)40℃时,将50gA物质加入100g水中,充分溶解后,形成溶液的质量为140g.
 如图是A物质的溶解度曲线图,如表是B物质在不同温度时的溶解度.
如图是A物质的溶解度曲线图,如表是B物质在不同温度时的溶解度. | 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| B物质溶解度/g | 32 | 35 | 40 | 45 | 55 |
(2)40℃时,A、B两种物质的饱和溶液中溶质的质量分数相等.
(3)若要从A的溶液中提取A物质,小明同学认为要用蒸发溶剂水的方法;小娟同学认为要用冷却热饱和溶液结晶的方法.你认为小娟同学的方法合理.
(4)40℃时,将50gA物质加入100g水中,充分溶解后,形成溶液的质量为140g.


 2NaHCO3 。下图表示将二氧化碳气体缓慢通入一定质量的碳酸钠溶液的过程中,某变量y随时间的变化趋势。纵坐标表示的是
2NaHCO3 。下图表示将二氧化碳气体缓慢通入一定质量的碳酸钠溶液的过程中,某变量y随时间的变化趋势。纵坐标表示的是