题目内容
将一定量Cu与Cu(OH)2的混合物置于坩埚中充分灼烧,结果所得固体质量恰等于原混合物的质量,则原混合物中铜元素的质量分数为(资料:Cu(OH)2
CuO+H20)( )
| ||
| A、40% | B、25% |
| C、60% | D、80% |
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:所得固体质量恰等于原混合物的质量,说明和铜反应的氧气的质量等于氢氧化铜受热分解生成水的质量,可以假设生成的水的质量或反应的氧气质量,进一步可以计算原混合物中铜元素的质量分数.
解答:解:加热条件下铜和氧气反应、氢氧化铜分解的化学方程式为:2Cu+O2
2CuO,Cu(OH)2
CuO+H2O,结果所得固体质量恰等于原混合物的质量,说明失去的水的质量等于得到的氧气的质量,所以设生成的水的质量为x,则得到的氧气质量也是x,所以原混合物中Cu的质量是4x,Cu(OH)2的质量是
x,原混合物中所含有的铜元素质量为:4x+
x,
则原混合物中铜元素的质量分数为:【(4x+
x)÷(4x+
x)】×100%=80%,
故选:D.
| ||
| ||
| 49 |
| 9 |
| 32 |
| 9 |
则原混合物中铜元素的质量分数为:【(4x+
| 32 |
| 9 |
| 49 |
| 9 |
故选:D.
点评:解答时,要以反应前后固体质量不变为突破口,找出参加反应的氧气质量和生成水的质量关系,通过合理地假设可以进行计算,这样可以减少计算量.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
取一定量的氧化铁和氧化铜的混合物,加入100克19.6%稀硫酸,恰好完全反应生成盐和水.原固体混合物中氧元素的质量是( )
| A、6.4g | B、1.6g |
| C、3.2g | D、12.8g |
 化学概念之间具有并列、包含、交叉等关系,如图表示概念m和n之间的包含关系,下表选项中,所列概念之间的关系符合图中所示包含关系的是( )
化学概念之间具有并列、包含、交叉等关系,如图表示概念m和n之间的包含关系,下表选项中,所列概念之间的关系符合图中所示包含关系的是( )| 选项 | A | B | C | D |
| m | 氧化物 | 纯净物 | 酸 | 化合反应 |
| n | 化合物 | 单质 | 碱 | 氧化反应 |
| A、A | B、B | C、C | D、D |
如图是一定条件下某化学反应的微观模拟示意图,下列说法错误的是( )


| A、该反应是化合反应 |
| B、参加反应的两种物质的分子个数比为1:1 |
| C、该反应前后,原子种类、数目不变 |
| D、该示意图中共有4种分子 |
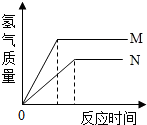 等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如图所示,下列叙述正确的是( )
等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如图所示,下列叙述正确的是( )| A、M、N反应消耗的盐酸质量相等 |
| B、生成H2的质量M<N |
| C、相对原子质量较大的是N |
| D、产生H2的速率N>M |
 已知水的沸点随压强的减少而降低.现有如图所示实验装置,夹子开始处于关闭状态.将液体A滴入试管②与气体B充分反应后,打开夹子,发现试管①内的水立刻沸腾.A和B最不可能的一种组合是( )
已知水的沸点随压强的减少而降低.现有如图所示实验装置,夹子开始处于关闭状态.将液体A滴入试管②与气体B充分反应后,打开夹子,发现试管①内的水立刻沸腾.A和B最不可能的一种组合是( )| A、A为NaOH溶液,B为CO2气体 |
| B、A为稀H2SO4溶液,B为NH3气体 |
| C、A为AgNO3溶液,B为HCl气体 |
| D、A为CaCl2溶液,B为CO2气体 |
