题目内容
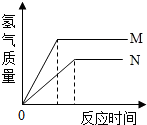 等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如图所示,下列叙述正确的是( )
等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如图所示,下列叙述正确的是( )| A、M、N反应消耗的盐酸质量相等 |
| B、生成H2的质量M<N |
| C、相对原子质量较大的是N |
| D、产生H2的速率N>M |
考点:金属的化学性质
专题:金属与金属材料
分析:根据图象中可以看出,等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应,生成氢气的质量M>N,反应速率在图象中的体现方式是直线斜率,直线的斜率越大,说明该反应的速率越大,从图象可以看出,M直线的斜率大于N,所以M的反应速率大于N,M的金属活动性大于N,金属M、N的质量相等,依据质量守恒定律,氢气中的氢元素来自盐酸,氢气质量不相等,参加反应的盐酸质量也一定不相等,依据金属与酸反应产生氢气的质量公式:氢气的质量=
,可以比较M、N两种金属相对原子质量的大小,然后结合图象进行分析解答.
| 金属在盐中的化合价 |
| 该金属的相对原子质量 |
解答:解:A、通过分析图象,依据质量守恒定律,氢气中的氢元素来自盐酸,氢气质量不相等,M、N反应消耗的盐酸质量也一定不相等,故A错误;
B、根据图表中纵坐标可知,生成H2的质量M>N,故B错误;
C、依据金属与酸反应产生氢气的质量公式:氢气的质量=
,因为金属是等质量的,化合价又相等,所以氢气的质量越多,该金属的相对原子质量越小,所以相对原子质量较大的是N,故C正确;
D、依据图表中M反应时间短,可知M的活动性比N强,所以产生H2的速率M>N,故D错误.
故选:C.
B、根据图表中纵坐标可知,生成H2的质量M>N,故B错误;
C、依据金属与酸反应产生氢气的质量公式:氢气的质量=
| 金属在盐中的化合价 |
| 该金属的相对原子质量 |
D、依据图表中M反应时间短,可知M的活动性比N强,所以产生H2的速率M>N,故D错误.
故选:C.
点评:该题考查了学生观察图表的能力,要求学生会根据图表判断金属的活动性,生成氢气质量的多少,反应速度的快慢,金属相对原子质量的大小,掌握住根据金属与酸反应产生氢气的质量公式,对以后的解题很有帮助.

练习册系列答案
相关题目
将一定量Cu与Cu(OH)2的混合物置于坩埚中充分灼烧,结果所得固体质量恰等于原混合物的质量,则原混合物中铜元素的质量分数为(资料:Cu(OH)2
CuO+H20)( )
| ||
| A、40% | B、25% |
| C、60% | D、80% |
为减缓全球气候变暖,2009年12月在哥本哈根召开了联合国气候变化大会,“低碳生活’成为热门话题.下列对策中,不恰当的是( )
| A、开发无污染的太阳能、风能、地热能等 |
| B、禁止乱砍滥伐,积极植树造林 |
| C、广泛使用一次性筷子、一次性塑料袋 |
| D、提倡乘坐公共交通工具、骑自行车出行 |
向含有AgNO3,Cu(NO3)2的混合溶液加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,无气体生成.下列说法错误的是( )
| A、滤出的固体中肯定没有Fe |
| B、滤出的固体中肯定含有Ag,Cu |
| C、滤液中可能含有AgNO3 |
| D、滤液中可能含有Cu(NO3)2 |




