题目内容
19.小海、小林、小明三同学一起测定双氧水溶液中溶质的质量分数.【查阅资料】:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;常温下氧气密度为1.42g/L.
【设计原理】:将一定质量的双氧水样品与二氧化锰混合,测定反应产生的氧气的质量,计算出H2O2的质量,继而得双氧水溶液中溶质的质量分数.
【过程方法】:
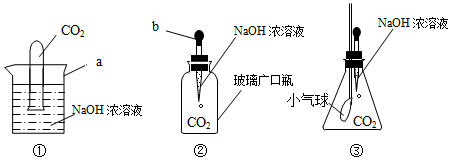
(1)小海首先设计(如图1):向装有样品溶液(20g)的锥形瓶(75g)中投入0.5g二氧化锰,待双氧水反应完毕后测得锥形瓶和反应后混合物的总质量为95.1g,则双氧水溶液中溶质的质量分数为4.25%.

(2)小明通过思考后,觉得他们的方案误差都较大,于是小明设计如图2的方案(试剂用量不变).请你说明小明认为他们误差较大的原因:氧气会带走水蒸气.
分析 (1)根据质量守恒定律可知,装置和药品的总质量在反应中减少的质量,就是生成氧气的质量,由氧气的质量依据过氧化氢分解的化学方程式可以计算出双氧水溶液中过氧化氢的质量分数进行分析;
(2)根据只有保证氧气中不含其它物质,才能减小误差进行分析.
解答 解:(1)由质量守恒定律可知:反应后生成氧气的质量为:20g+75g+0.5g-95.1g=0.4g,
设双氧水溶液中过氧化氢的质量分数为x
2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
68 32
20g×x 0.4g
$\frac{68}{20g×x}$=$\frac{32}{0.4g}$
x=4.25%
(2)用小海设计的装置收集到的氧气中含有少量的水蒸气,使计算出的氧气的质量变大,从而会造成误差.
故答案为:(1)4.25%;
(2)氧气会带走水蒸气.
点评 本题主要考查质量守恒定律的应用、化学方程式的计算、减小误差的措施和仪器的选择,难度稍大,综合性较强.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
6.探究金属活动性顺序时,将锌粒放入硫酸铜溶液中,锌粒表面有紫红色物质析出,还有无色无味气体产生的“异常”现象.推测该气体可能是( )
| A. | 二氧化硫 | B. | 氢气 | C. | 二氧化碳 | D. | 一氧化碳 |
4.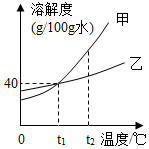 甲、乙两种固体均不含结晶水,在水中不发生反应且溶解性互不影响,它们的溶解度曲线如图所示.下列说法正确的是( )
甲、乙两种固体均不含结晶水,在水中不发生反应且溶解性互不影响,它们的溶解度曲线如图所示.下列说法正确的是( )
 甲、乙两种固体均不含结晶水,在水中不发生反应且溶解性互不影响,它们的溶解度曲线如图所示.下列说法正确的是( )
甲、乙两种固体均不含结晶水,在水中不发生反应且溶解性互不影响,它们的溶解度曲线如图所示.下列说法正确的是( )| A. | t1℃甲、乙的饱和溶液,降低温度,甲先析出晶体 | |
| B. | t1℃时,70g甲的饱和溶液加入40g乙物质,溶液质量仍为70g | |
| C. | 将t2℃甲、乙的饱和溶液分别降温至t1℃,析出晶体的质量:甲>乙 | |
| D. | 将t2℃等质量的甲、乙饱和溶液分别降温至t1℃,析出晶体的质量:甲>乙 |
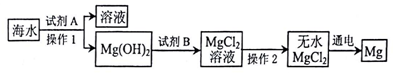
11.对如图所示实验分析正确的是( )


| A. | 可能发生了一系列物理变化 | B. | 甲中有未溶解的氧化钙 | ||
| C. | 操作Ⅱ一定是升高温度 | D. | 乙中液体可能呈中性 |