题目内容
18.某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾.其设计的实验过程为: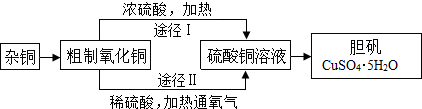
(1)将杂铜灼烧以除去其中的杂质,此过程中可能产生大量二氧化碳和少量一氧化碳.杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾.灼烧后含有少量铜的可能原因是A、B.
A.灼烧过程中部分氧化铜被还原 B.灼烧不充分铜未被完全氧化
C.氧化铜在加热过程中分解生成铜 D.该条件下铜无法被氧气氧化
(2)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是产生等量胆矾途径Ⅱ消耗硫酸少、途径Ⅱ不会产生污染大气的气体
(3)在测定所得胆矾(CuSO4•xH2O)中结晶水x值的实验过程中:称量操作至少进行4次.
(4)若测定结果x值偏高,可能的原因是a(填字母编号).
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化.
分析 (1)根据氧化铜和铜的性质分析,铜在加热的条件下易生成氧化铜,氧化铜稳定,难以分解;
(2)根据途径Ⅰ有浓硫酸参加,消耗硫酸较多,并产生污染性气体二氧化硫进行分析;
(3)根据需要称量坩埚的质量,坩埚和晶体的质量,加热后坩埚的质量,加热后再称量一次坩埚的质量,判断质量是否发生变化,共称量4次进行分析;
(4)a、根据加热温度过高,会导致硫酸铜分解,质量变化较大进行分析;
b、根据胆矾晶体的颗粒较大,会导致晶体受热分解不完全,质量变化较小,结果偏小进行分析;
c、根据加热后放在空气中冷却,会吸收空气中的水重新形成晶体,结果偏小进行分析;
d、根据胆矾晶体部分分化,会使水的含量较小,结果偏小进行分析.
解答 解:(1)铜在加热的条件下易生成氧化铜,氧化铜稳定,难以分解,故选:AB;
(2)途径Ⅰ有浓硫酸参加,消耗硫酸较多,并产生污染性气体二氧化硫,所以与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:产生等量胆矾途径Ⅱ消耗硫酸少,途径Ⅱ不会产生污染大气的气体;
(3)测定所得胆矾(CuSO4•xH2O)中结晶水x值,需要称量坩埚的质量,坩埚和晶体的质量,加热后坩埚的质量,加热后再称量一次坩埚的质量,判断质量是否发生变化,共称量4次;
(4)a、加热温度过高,会导致硫酸铜分解,质量变化较大,导致结果偏大,故a正确;
b、胆矾晶体的颗粒较大,会导致晶体受热分解不完全,质量变化较小,结果偏小,故b错误;
c、加热后放在空气中冷却,会吸收空气中的水重新形成晶体,结果偏小,故c错误;
d、胆矾晶体部分分化,会使水的含量较小,结果偏小,故d错误.
故选:a.
故答案为:(1)A、B;
(2)产生等量胆矾途径Ⅱ消耗硫酸少,途径Ⅱ不会产生污染大气的气体;
(3)4;
(4)a.
点评 本题主要考查硫酸铜晶体的制备方案设计,涉及化学实验操作,难度不大.

| A. | 食用加碘盐可预防大脖子病,所以应尽量多吃 | |
| B. | 煤、石油、天然气都是不可再生的能源 | |
| C. | 用甲醛溶液浸泡鱿鱼,以保质保鲜 | |
| D. | 生石灰制成的食品干燥剂可以食用 |
| 污染指数 | 50以下 | 51~100 | 101~200 | 201~250 | 251~300 | 300以上 |
| 质量级别 | I | Ⅱ | Ⅲ | IV(1) | IV(2) | V |
| 质量状况 | 好 | 良好 | 轻度污染 | 中度污染 | 中度重污染 | 重度污染 |
| A. | I级 好 | B. | Ⅲ级 轻度污染 | C. | Ⅱ级 良好 | D. | V级 重度污染 |
| A. | 过氧化氢溶液是纯净物 | B. | 过氧化氢中氧元素的化合价为-1价 | ||
| C. | 过氧化氢由氢原子和氧原子构成的 | D. | 过氧化氢与水属于同种物质 |
首先,将其分为四等份,再分别加入不同质量的氯化钡溶液,数据如下:(钾肥中其他成分溶于水且不与氯化钡反应)
| 实验 | 第一次 | 第二次 | 第三次 | 第四次 |
| 钾肥 | 60g | 60g | 60g | 60g |
| 加入氯化钡溶液 | 10g | 200g | 400g | 500g |
| 反应后得到硫酸钡沉淀 | 11.65g | 23.3g | 46.6g | 46.6g |
(2)该钾肥中硫酸钾的质量分数是否达到标签含量(写出计算过程).


 小明同学绘制了如图所示A、B两种固体物质的溶解度曲线:
小明同学绘制了如图所示A、B两种固体物质的溶解度曲线: