题目内容
19.小明对一种暗紫色固体进行实验,实验过程如图.请回答下列问题:
(1)判断下列物质:B是氧气;C是二氧化锰;D是锰酸钾;E是氯酸钾,F是过氧化氢溶液.
(2)写出反应②的符号表达式2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;写出反应③的符号表达式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,该反应的基本类型是分解反应.
(3)如果X是红色固体,反应条件是加热,则反应④的符号表达式是:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;该反应的基本类型是化合反应.
(4)固体C在反应②和③中所起的作用是催化作用.
分析 根据暗紫色固体在加热的条件下分解产生的气体B能与黄色固体Y生成气体H,所以可以推断A为高锰酸钾,而B为氧气,Y是硫,H是二氧化硫,高锰酸钾分解会生成锰酸钾、二氧化锰和氧气,固体C会与白色固体、无色液体反应生成氧气,所以C是二氧化锰,D是锰酸钾,E是氯酸钾,F是过氧化氢溶液,氧气和X会生成黑色固体,所以X可以是铜,G是氧化铜,然后将推出的物质进行验证即可.
解答 解:(1)暗紫色固体在加热的条件下分解产生的气体B能与黄色固体Y生成气体H,所以可以推断A为高锰酸钾,而B为氧气,Y是硫,H是二氧化硫,高锰酸钾分解会生成锰酸钾、二氧化锰和氧气,固体C会与白色固体、无色液体反应生成氧气,所以C是二氧化锰,D是锰酸钾,E是氯酸钾,F是过氧化氢溶液,氧气和X会生成黑色固体,所以X可以是铜,G是氧化铜,经过验证,推导正确,所以B是氧气,C是二氧化锰,D是锰酸钾,E是氯酸钾,F是过氧化氢溶液;
(2)反应②是氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,符号表达式为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,反应③是过氧化氢在二氧化锰的催化作用下生成水和氧气,符号表达式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,该反应满足分解反应一变多的条件,属于分解反应;
(3)如果X是红色固体,反应条件是加热,则反应④是铜和氧气在加热的条件下反应生成氧化铜,化学方程式为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,该反应满足化合反应多变一的条件,属于化合反应;
(4)通过推导可知,固体C是二氧化锰,在反应②和③中所起的作用是催化作用.
故答案为:(1)氧气,二氧化锰,锰酸钾,氯酸钾,过氧化氢溶液;
(2)2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,分解反应;
(3)2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,化合反应;
(4)催化.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案| A. | 空气的主要成分是氮气和氧气 | |
| B. | 氧气能够燃烧 | |
| C. | 煤燃烧产生大量的二氧化碳是造成酸雨的罪魁祸首 | |
| D. | 用一氧化碳做燃料,产生二氧化碳,从而防止温室效应进一步增强 |
探究一 气体发生装置的选择

(1)写出图中带标号仪器的名称:a试管;b集气瓶.
(2)实验室制取二氧化碳气体,发生和收集装置分别选用B 和D (填字母),检验集满二氧化碳的方法是将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了.
探究二 药品的选择
小明对三组药品进行了研究,实验记录如下:
| 组别 | 药 品 | 实验现象 |
| ① | 块状石灰石和稀盐酸 | 产生气泡速率适中 |
| ② | 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
| ③ | 粉末状石灰石和稀盐酸 | 产生气泡速率很快 |
对照实验①②,是探究不同的酸对产生二氧化碳速率的影响;
小明选择第①组药品来制取二氧化碳,该组反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑
探究三 生成二氧化碳量的测定
实验室常通过下列两种途径测量生成二氧化碳的量

途径一(如图1):由图可知产生二氧化碳的质量为2.2g.
途径二(如图2):通过排水法测得生成二氧化碳的体积.
由上两种途径比较,你认为途径一实验结果更为准确,理由是途径二中部分二氧化碳溶于水.
探究四 探究二氧化碳的性质:为了探究二氧化碳的性质,小明设计了如图3所示的实验:
用注射器注入稀盐酸,一段时间后,可观察到的现象有2处紫色石蕊溶液变红色;3处澄清石灰水变浑浊.

 在对蜡烛及其燃烧进行了探究以后,请你填写下列空格:
在对蜡烛及其燃烧进行了探究以后,请你填写下列空格: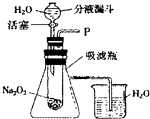 “在学校的元旦联欢会上,某同学表演了‘水能生火’的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来了.”
“在学校的元旦联欢会上,某同学表演了‘水能生火’的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来了.”