题目内容
3.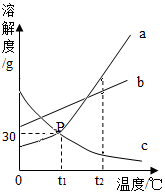 如图是a、b、c三种物质(不含结晶水)的溶解度曲线,a与c的溶解度曲线交于P点,请据图回答
如图是a、b、c三种物质(不含结晶水)的溶解度曲线,a与c的溶解度曲线交于P点,请据图回答(1)P点的含义是t1℃时,a、c物质的溶解度相等.
(2)将t1℃时a、b、c三种物质的饱和溶液温度升高到t2℃时,三种溶液的溶质质量分数大小关系是D(填选项序号)
A、c=a>b B、a=b>c C、a>b>c D、b>a>c.
分析 根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:(1)通过分析溶解度曲线可知,P点的含义是:t1℃时,a、c物质的溶解度相等;
(2)t1℃时,b物质的溶解度最大,a、c物质的溶解度相等,升高温度,a、b物质不会析出晶体,c物质会析出晶体,所以将t1℃时a、b、c三种物质的饱和溶液温度升高到t2℃时,三种溶液的溶质质量分数大小关系是b>a>c,故选:D.
故答案为:(1)t1℃时,a、c物质的溶解度相等;
(2)D.
点评 本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.

练习册系列答案
相关题目
14.水变成水蒸气的过程中,发生变化的时( )
| A. | 分子质量 | B. | 分子种类 | C. | 分子间隔 | D. | 分子大小 |
18. 实验室有一变质的氢氧化钠样品(样品中只含碳酸钠杂质,且成分均匀),为测量样品中Na2CO3的质量分数,小明进行了如下实验.
实验室有一变质的氢氧化钠样品(样品中只含碳酸钠杂质,且成分均匀),为测量样品中Na2CO3的质量分数,小明进行了如下实验.
①取质量、大小相同的3个烧杯,分别加入一定质量分数的稀盐酸100克;
②向上述3个烧杯中分别加入3份质量不同的样品;
③充分反应后,再用电子天平称量烧杯及烧杯内物质的总质量(假设产生的气体完全逸出).实验数据如下:
已知实验中发生的化学反应:NaOH+HCl═NaCl+H2O
Na2CO3+2HCl═2NaCl+H2O+CO2↑
(1)分析表中数据,写出判断实验二中的样品已完全反应的理由:实验三产生的气体的质量为150g+12g-158.7g=3.3g,实验二产生的气体的质量为150g+8g-155.8g=2.2g,实验三产生的气体的质量大于实验二,所以实验二中稀盐酸有剩余,8g样品已完全反应..
(2)表中的m值为152.9.
(3)根据实验二中的数据计算样品中Na2CO3的质量分数.
 实验室有一变质的氢氧化钠样品(样品中只含碳酸钠杂质,且成分均匀),为测量样品中Na2CO3的质量分数,小明进行了如下实验.
实验室有一变质的氢氧化钠样品(样品中只含碳酸钠杂质,且成分均匀),为测量样品中Na2CO3的质量分数,小明进行了如下实验.①取质量、大小相同的3个烧杯,分别加入一定质量分数的稀盐酸100克;
②向上述3个烧杯中分别加入3份质量不同的样品;
③充分反应后,再用电子天平称量烧杯及烧杯内物质的总质量(假设产生的气体完全逸出).实验数据如下:
| 实验一 | 实验二 | 实验三 | |
| 反应前稀盐酸+烧杯质量(克) | 150 | 150 | 150 |
| 反应前固体样品质量(克) | 4 | 8 | 12 |
| 反应后烧杯内物质+烧杯质量(克) | m | 155.8 | 158.7 |
Na2CO3+2HCl═2NaCl+H2O+CO2↑
(1)分析表中数据,写出判断实验二中的样品已完全反应的理由:实验三产生的气体的质量为150g+12g-158.7g=3.3g,实验二产生的气体的质量为150g+8g-155.8g=2.2g,实验三产生的气体的质量大于实验二,所以实验二中稀盐酸有剩余,8g样品已完全反应..
(2)表中的m值为152.9.
(3)根据实验二中的数据计算样品中Na2CO3的质量分数.
8.下列物质属于纯净物的是( )
| A. | 液氮 | B. | 碘酒 | C. | 石油 | D. | 石灰浆 |
15.下列物质的用途、性质均正确且有对应关系的是( )
| 选项 | 物质 | 用途 | 性质 |
| A | 石墨 | 电池电极 | 石墨很软 |
| B | CO | 冶炼金属 | CO有可燃性 |
| C | 熟石灰 | 改良酸性土壤 | 熟石灰显碱性 |
| D | 小苏打 | 治疗胃酸过多 | 小苏打易分解 |
| A. | A | B. | B | C. | C | D. | D |
12.下列有关分子的说法中,不正确的是( )
| A. | 分子的质量和体积都很小 | B. | 温度升高,分子的体积变大 | ||
| C. | 分子在不停地运动 | D. | 温度越高,分子运动速率越快 |
10.以电石渣[主要成分Ca(OH)2和CaCO3]为原料制备KClO3的流程如图.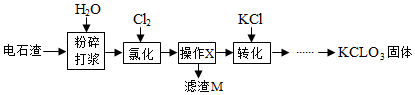
查阅资料:在75℃左右,氯化步骤中氯气转化成Ca(ClO3)2时发生一系列的反应,其中Cl2与Ca(OH)2反应的总化学方程式可表示为:
6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+aH2O
(1)氯化前,先将电石渣粉碎的目的是增大反应物的接触面积,加快反应速率.
(2)氯化步骤中所得产物氯酸钙Ca(ClO3)2中Cl的化合价为+5价,a数值为6.
(3)操作X为过滤.转化步骤中Ca(ClO3)2与KCl反应生成KClO3的化学方程式为Ca(ClO3)2+2KCl=2KClO3+CaCl2.(相关物质的溶解度见下表)
(4)对滤渣M的成分进行探究
【提出问题】滤渣M中除了电石渣原有的不溶性杂质外,还含有什么物质?
【猜想假设】①CaCO3; ②Ca(OH)2; ③CaCO3和Ca(OH)2.
【实验验证】

查阅资料:在75℃左右,氯化步骤中氯气转化成Ca(ClO3)2时发生一系列的反应,其中Cl2与Ca(OH)2反应的总化学方程式可表示为:
6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+aH2O
(1)氯化前,先将电石渣粉碎的目的是增大反应物的接触面积,加快反应速率.
(2)氯化步骤中所得产物氯酸钙Ca(ClO3)2中Cl的化合价为+5价,a数值为6.
(3)操作X为过滤.转化步骤中Ca(ClO3)2与KCl反应生成KClO3的化学方程式为Ca(ClO3)2+2KCl=2KClO3+CaCl2.(相关物质的溶解度见下表)
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| T℃时溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
【提出问题】滤渣M中除了电石渣原有的不溶性杂质外,还含有什么物质?
【猜想假设】①CaCO3; ②Ca(OH)2; ③CaCO3和Ca(OH)2.
【实验验证】
| 实验步骤 | 实验现象 | 结论 |
| 步骤1:取少量滤渣M加入盛水的小烧杯中,搅拌,静置后先加入几滴无色酚酞试液; | 观察到溶液变红色现象 | 猜想①不正确 |
| 步骤2:向小烧杯中继续加入足量的稀盐酸 | 观察到固体溶解并有气泡产生现象 | 猜想③正确 |