题目内容
14. 化学家谢赫特曼研究发现:铝锰合金晶体中的原子排列方式没有出现“规则有序而重复排列”的普遍现象,提出了“准晶体”概念,因此获得2011年诺贝尔化学奖.下列观点正确的是( )
化学家谢赫特曼研究发现:铝锰合金晶体中的原子排列方式没有出现“规则有序而重复排列”的普遍现象,提出了“准晶体”概念,因此获得2011年诺贝尔化学奖.下列观点正确的是( )| A. | 铝锰合金的强度和硬度比铝高 | |
| B. | 铝锰合金不具有导电导热性 | |
| C. | 铝的直接构成微粒是铝分子 | |
| D. | 合金中原子排列方式与纯金属的原子排列方式相同 |
分析 A、根据合金的性质进行分析判断.
B、根据合金具有金属的特性,结合合金的性质进行分析判断.
C、根据金属是由原子直接构成的,据此进行分析判断.
D、根据题意,铝锰合金晶体中的原子排列方式没有出现“规则有序而重复排列”的普遍现象,进行分析判断.
解答 解:A、合金的硬度和强度比组成它的纯金属的硬度大,铝锰合金的强度和硬度比铝高,故选项说法正确.
B、合金具有金属的特性,铝锰合金具有导电、导热性,故选项说法错误.
C、金属是由原子直接构成的,铝的直接构成微粒是铝原子,故选项说法错误.
D、铝锰合金晶体中的原子排列方式没有出现“规则有序而重复排列”的普遍现象,说明合金中原子排列方式与纯金属的原子排列方式不同,故选项说法错误.
故选:A.
点评 本题难度不大,了解合金的性质与用途、金属是由原子直接构成的等是正确解答本题的关键.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
4.某同学为了除去炭粉中混有的少量氧化铜而得到纯净的炭粉,设计了如下方案:①直接将混合物高温加热;②加入稀硫酸并微热后过滤、干燥;③通入(CO并加热;④在CO2气流中高温灼烧.正确的是( )
| A. | ①④ | B. | ②③ | C. | ② | D. | ④ |
19.下列四个图象分别对应四种操作过程,其中不正确的是( )
| A. | 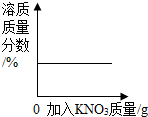 向饱和KNO3溶液中加入KNO3 | |
| B. | 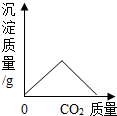 向CaCl2溶液中通入CO2 | |
| C. | 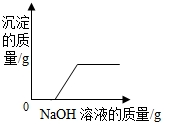 向CuCl2和HCl的混合溶液中加入过量NaOH溶液 | |
| D. | 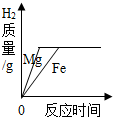 向两份同体积和同质量分数的HCl溶液中分别加入足量的铁粉和镁粉 |
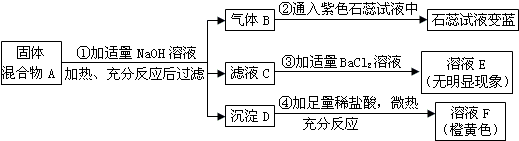
6.同学们用碳酸钠溶液和盐酸的反应验证质量守恒定律,实验后他们对残留废液的成分进行探究.
【推理假设】上述两种物质发生反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑,由此推测出废液中一定有NaCl,可能有Na2CO3或盐酸.
【实验探究】(1)确定废液中是否含有盐酸:
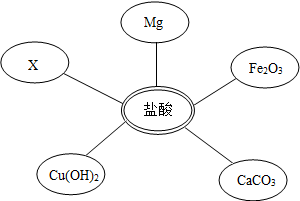
①选择试剂:根据盐酸的化学性质,同学们选用了如图所示的五种物质,其中物质X是酸碱指示剂中的石蕊溶液.
②实验验证:某同学向废液中加入少量的镁粉,观察到无气泡产生(或无现象或无变化),确定废液中一定没有盐酸.
(2)确定废液中是否含有Na2CO3:某同学选用pH试纸(或pH计)测出废液的pH=l0,确定废液中一定含有Na2CO3.
(3)处理废液,回收利用:欲从废液中得到纯净的NaCl,请完成如下实验方案设计.
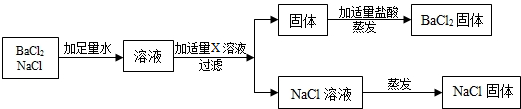
(4)拓展运用:按如图方案分离BaCl2和NaCl的固体混合物时,X溶液中溶质是Na2CO3.相关反应方程式如下Na2CO3+BaCl2=BaCO3↓+2NaCl;BaCO3+2HCl=BaCl2+H2O+CO2↑.
【推理假设】上述两种物质发生反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑,由此推测出废液中一定有NaCl,可能有Na2CO3或盐酸.
【实验探究】(1)确定废液中是否含有盐酸:
①选择试剂:根据盐酸的化学性质,同学们选用了如图所示的五种物质,其中物质X是酸碱指示剂中的石蕊溶液.

②实验验证:某同学向废液中加入少量的镁粉,观察到无气泡产生(或无现象或无变化),确定废液中一定没有盐酸.
(2)确定废液中是否含有Na2CO3:某同学选用pH试纸(或pH计)测出废液的pH=l0,确定废液中一定含有Na2CO3.
(3)处理废液,回收利用:欲从废液中得到纯净的NaCl,请完成如下实验方案设计.
| 方案 | 加入试剂 | 提纯的方法 | 方案评价 |
| 一 | 适量Ca(NO3)2溶液 | 过滤、蒸发结晶 | (选填可行或不可行) |
| 二 | 稍过量的盐酸(或稀HCl或HCl) | 蒸发结晶 | 可行 |


 如图所示,各连线两端物质相互都能发生反应,试推断X可能是C
如图所示,各连线两端物质相互都能发生反应,试推断X可能是C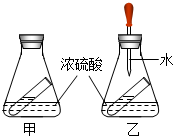 如图是小婧对硫酸的一些性质的探究,锥形瓶内的小试管盛装饱和的澄清石灰水.
如图是小婧对硫酸的一些性质的探究,锥形瓶内的小试管盛装饱和的澄清石灰水. 自行车是比较常见的一种交通工具.制作自行车使用最多的金属是铁.铁在空气中往往容易生锈.人们为了防止铁制品生锈.在自行车的不同部位采取不同的防锈措施.例如:支架采取的防锈措施是刷漆,其防锈原理是隔绝氧气和水.
自行车是比较常见的一种交通工具.制作自行车使用最多的金属是铁.铁在空气中往往容易生锈.人们为了防止铁制品生锈.在自行车的不同部位采取不同的防锈措施.例如:支架采取的防锈措施是刷漆,其防锈原理是隔绝氧气和水.