题目内容
4.实验室制取气体常常用到下列装置,根据给出的装置回答下列问题:
(1)写出标号仪器的名称:①锥形瓶;②集气瓶.
(2)若该实验选择装置A来制取氧气,请写出该反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(3)若选择高锰酸钾制取并收集较纯净的O2,则应选择装置BC.该套装置有一处不足的地方,请你指出并加以改进:在试管口放一团棉花.
(4)用图F装置可以收集氧气.若用排空气法收集氧气,气体应从a(填“a”或“b”)端通入;若用排水法来收集氧气,气体应从b(填“a”或“b”)端通入.
(5)某同学从上述装置图中选用适当装置成功的制备和收集了二氧化碳.选用的发生装置是A(填字母),收集装置是D(填字母).该反应的化学方程式是CaCO3+2HCl=CaCl2+H2O+CO2↑.为了进一步验证产生的气体是二氧化碳,该同学将气体通入图F装置中,则F装置中应加入的试剂为澄清的石灰水(填试剂名称),反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O.若在F装置中加入紫色石蕊试液,则观察到的现象是紫色变红色.
(6)常温下,在试管中分别加入下列物质,把带火星的木条伸入试管,不能使木条复燃的是A.
A.5mL 5%的过氧化氢溶液
B.5mL 5%的过氧化氢溶液和少量二氧化锰
C.5mL 5%的过氧化氢溶液和少量硫酸铜溶液
D.5mL 5%的过氧化氢溶液和少量红砖粉末.
分析 锥形瓶是常用的反应容器,集气瓶是收集气体的仪器;制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集,排水法收集的氧气比较纯净.用图F装置可以收集氧气,若用排空气法收集氧气,气体应从长管进入,因为氧气的密度比空气大;若用排水法来收集氧气,气体应从短管进入,因为氧气的密度比水小.实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳一般用澄清的石灰水检验:把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳;若在F装置中加入紫色石蕊试液,则观察到的现象是紫色变红色,因为二氧化碳与水反应生成碳酸,碳酸能使紫色石蕊试液变成红色.常温下,在试管中分别加入下列物质,把带火星的木条伸入试管,不能使木条复燃的是:5mL5%的过氧化氢溶液,因为二氧化锰、硫酸铜溶液、红砖粉末都起了催化作用.
解答 解:(1)锥形瓶是常用的反应容器,集气瓶是收集气体的仪器,故答案为:锥形瓶;集气瓶;
(2)过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,要注意配平;故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(3)加热高锰酸钾时,试管口要放一团棉花,是为了防止高锰酸钾粉末进入导管;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集,排水法收集的氧气比较纯净;故答案为:BC;在试管口放一团棉花;
(4)用图F装置可以收集氧气,若用排空气法收集氧气,气体应从长管进入,因为氧气的密度比空气大;若用排水法来收集氧气,气体应从短管进入,因为氧气的密度比水小;故答案为:a;b;
(5)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳一般用澄清的石灰水检验:把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳;若在F装置中加入紫色石蕊试液,则观察到的现象是紫色变红色,因为二氧化碳与水反应生成碳酸,碳酸能使紫色石蕊试液变成红色;故答案为:A;D;CaCO3+2HCl=CaCl2+H2O+CO2↑;澄清的石灰水;Ca(OH)2+CO2=CaCO3↓+H2O;紫色变红色;
(6)常温下,在试管中分别加入下列物质,把带火星的木条伸入试管,不能使木条复燃的是:5mL5%的过氧化氢溶液,因为二氧化锰、硫酸铜溶液、红砖粉末都起了催化作用;故答案为:A;
点评 本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写、气体的检验和性质等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案| 海水密度/(g•mL-1) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
A.各种盐的溶解度增大 B.海水中水的质量分数不变
C.析出粗盐中NaCl的质量分数增大 D.海水中Br-的质量分数不变
(2)海水在浓缩过程中,最先析出的盐是硫酸钙.实际晒盐生产中,海水的密度一般控制在1.21g•mL-1~1.26g•mL-1范围内.由上表可知,所得粗盐中含有的杂质离子有Ca2+,Mg2+,SO42-;Br-.
(3)如图能较正确地反映浓缩过程中海水中NaCl的质量分数(A%)与海水密度(d)的关系的是B.

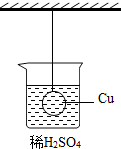 如图所示,一悬挂铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )
如图所示,一悬挂铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )| A. | 变大 | B. | 变小 | C. | 不变 | D. | 无法判断 |


 初中几种常见物质间的反应及转化关系如图所示,物质B是一种红色固体粉末,该图体现了化合物F的四种不同化学性质,请依据此图完成下列问题.
初中几种常见物质间的反应及转化关系如图所示,物质B是一种红色固体粉末,该图体现了化合物F的四种不同化学性质,请依据此图完成下列问题.