题目内容
铁及其化合物在生活生产中有重要的应用.请回答下列问题:
(1)在盛有氧气的集气瓶中点燃细铁丝发生剧烈燃烧的化学方程式是 .
(2)把铁粉和铜粉的混合物放入硝酸银溶液中,充分反应后,过滤,为确定滤渣和滤液的成分,甲同学向滤渣中滴加稀盐酸,无气泡产生; 乙同学向滤液中滴加稀盐酸,产生白色沉淀.根据两同学实验的现象,分析下列结论不正确的是 (填序号).
A.滤渣中只含银 B.滤渣中一定含有银,可能含有铜
C.滤液中一定有Ag+、Fe2+和Cu2+D.滤液中只含Ag+和Fe2+,不含Cu2+
【探究】废旧金属的回收利用.
废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),生产动物饲料添加剂硫酸亚铁的工艺之一如图所示:

(3)在反应器中发生反应的化学方程式有:
Fe+H2SO4═FeSO4+H2↑、 、Fe2(SO4)3+Fe═3FeSO4.
(4)滤液M中肯定含有的溶质的化学式是 ;
(5)在化学反应中,凡是有元素化合价变化的反应属于氧化还原反应.下列反应类型肯定属于氧化还原反应的是 (填字母编号);
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
(6)取表面含有氧化镁的镁条(无其它杂质)2.5g,加入到足量的20.0g的稀硫酸中,充分反应后,所得溶液的质量为22.3g.求:①生成氢气的质量;②该镁条中单质镁的质量分数(写出计算过程).
(1)在盛有氧气的集气瓶中点燃细铁丝发生剧烈燃烧的化学方程式是
(2)把铁粉和铜粉的混合物放入硝酸银溶液中,充分反应后,过滤,为确定滤渣和滤液的成分,甲同学向滤渣中滴加稀盐酸,无气泡产生; 乙同学向滤液中滴加稀盐酸,产生白色沉淀.根据两同学实验的现象,分析下列结论不正确的是
A.滤渣中只含银 B.滤渣中一定含有银,可能含有铜
C.滤液中一定有Ag+、Fe2+和Cu2+D.滤液中只含Ag+和Fe2+,不含Cu2+
【探究】废旧金属的回收利用.
废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),生产动物饲料添加剂硫酸亚铁的工艺之一如图所示:

(3)在反应器中发生反应的化学方程式有:
Fe+H2SO4═FeSO4+H2↑、
(4)滤液M中肯定含有的溶质的化学式是
(5)在化学反应中,凡是有元素化合价变化的反应属于氧化还原反应.下列反应类型肯定属于氧化还原反应的是
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
(6)取表面含有氧化镁的镁条(无其它杂质)2.5g,加入到足量的20.0g的稀硫酸中,充分反应后,所得溶液的质量为22.3g.求:①生成氢气的质量;②该镁条中单质镁的质量分数(写出计算过程).
考点:金属的化学性质,氧化反应,还原反应,根据化学反应方程式的计算
专题:有关化学方程式的计算,金属与金属材料
分析:(1)根据铁丝在氧气中燃烧生成四氧化三铁,进行解答;
(2)根据三种金属活动性强弱关系铁>铜>银,对将铁粉和铜粉的混合物放入硝酸银溶液中可能出现的变化进行分析,判断反应结束后剩余固体成分.
(3)根据氧化铁都能和稀硫酸反应,可以据此写出反应的化学方程式;
(4)加入的硫酸是过量的,所以在溶液中含有硫酸和反应生成的硫酸亚铁,可以据此解答该题;
(5)根据四种基本反应类型的特点来解答该题;
(6)根据质量守恒定律求出氢气的质量,然后根据镁和稀硫酸反应的化学方程式计算镁的质量解答.
(2)根据三种金属活动性强弱关系铁>铜>银,对将铁粉和铜粉的混合物放入硝酸银溶液中可能出现的变化进行分析,判断反应结束后剩余固体成分.
(3)根据氧化铁都能和稀硫酸反应,可以据此写出反应的化学方程式;
(4)加入的硫酸是过量的,所以在溶液中含有硫酸和反应生成的硫酸亚铁,可以据此解答该题;
(5)根据四种基本反应类型的特点来解答该题;
(6)根据质量守恒定律求出氢气的质量,然后根据镁和稀硫酸反应的化学方程式计算镁的质量解答.
解答:解:
(1)铁丝在氧气中燃烧生成四氧化三铁,则化学方程式为3Fe+2O2
Fe3O4;
(2)根据三种金属活动性强弱关系铁>铜>银,将铁粉和铜粉的混合物放入硝酸银溶液中,铁粉、铜粉都能与硝酸银发生反应得到银,因此剩余固体中一定含有银,甲同学向滤渣中滴加稀盐酸,无气泡产生,说明铁全部反应;乙同学向滤液中滴加稀盐酸,产生白色沉淀,说明溶液中含有硝酸银,所以可确定铜和硝酸银反应且铜的量不足还有硝酸银没反应;铁和硝酸银反应生成硝酸亚铁和银,铜和硝酸银反应生成硝酸铜和银,所以所得固体中只含有银,所得溶液中含有亚铁离子、铜离子和银离子;所以BD说法不正确.
(3)氧化铁都能和稀硫酸反应生成了硫酸亚铁和氢气,而反应生成了硫酸铁和水,反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(4)加入的硫酸是过量的,所以在溶液中含有硫酸和反应生成的硫酸亚铁;
(5)根据四种基本反应类型的特点可以知道,在置换反应中有单质参与和生成新的单质,所以可以判断在置换反应中一定有化合价的变化,故选B;
(6)反应产生的氢气质量:2.5g+20.0g-22.3g=0.2g.
设:2.5g镁条样品中单质镁的质量为x.
Mg+H2SO4=MgSO4+H2↑
24 2
x 0.2g
则
=
,解得x=2.4g
该镁条中单质镁的质量分数=
×100%=96%
答:该镁条中单质镁的质量分数为96%.
故答案:
(1)3Fe+2O2
Fe3O4;(2)BD;(3)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(4)FeSO4、H2SO4;(5)B;(6)96%.
(1)铁丝在氧气中燃烧生成四氧化三铁,则化学方程式为3Fe+2O2
| ||
(2)根据三种金属活动性强弱关系铁>铜>银,将铁粉和铜粉的混合物放入硝酸银溶液中,铁粉、铜粉都能与硝酸银发生反应得到银,因此剩余固体中一定含有银,甲同学向滤渣中滴加稀盐酸,无气泡产生,说明铁全部反应;乙同学向滤液中滴加稀盐酸,产生白色沉淀,说明溶液中含有硝酸银,所以可确定铜和硝酸银反应且铜的量不足还有硝酸银没反应;铁和硝酸银反应生成硝酸亚铁和银,铜和硝酸银反应生成硝酸铜和银,所以所得固体中只含有银,所得溶液中含有亚铁离子、铜离子和银离子;所以BD说法不正确.
(3)氧化铁都能和稀硫酸反应生成了硫酸亚铁和氢气,而反应生成了硫酸铁和水,反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(4)加入的硫酸是过量的,所以在溶液中含有硫酸和反应生成的硫酸亚铁;
(5)根据四种基本反应类型的特点可以知道,在置换反应中有单质参与和生成新的单质,所以可以判断在置换反应中一定有化合价的变化,故选B;
(6)反应产生的氢气质量:2.5g+20.0g-22.3g=0.2g.
设:2.5g镁条样品中单质镁的质量为x.
Mg+H2SO4=MgSO4+H2↑
24 2
x 0.2g
则
| 24 |
| x |
| 2 |
| 0.2g |
该镁条中单质镁的质量分数=
| 2.4g |
| 2.5g |
答:该镁条中单质镁的质量分数为96%.
故答案:
(1)3Fe+2O2
| ||
(4)FeSO4、H2SO4;(5)B;(6)96%.
点评:掌握化学方程式的书写、盐的化学性质等知识,并学会分析信息、提取信息,并应用所学知识结合所给信息进行解答,考查了学生分析、解决问题的能力.

练习册系列答案
相关题目
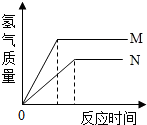 等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如图所示,下列叙述正确的是( )
等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如图所示,下列叙述正确的是( )| A、M、N反应消耗的盐酸质量相等 |
| B、生成H2的质量M<N |
| C、相对原子质量较大的是N |
| D、产生H2的速率N>M |
 已知水的沸点随压强的减少而降低.现有如图所示实验装置,夹子开始处于关闭状态.将液体A滴入试管②与气体B充分反应后,打开夹子,发现试管①内的水立刻沸腾.A和B最不可能的一种组合是( )
已知水的沸点随压强的减少而降低.现有如图所示实验装置,夹子开始处于关闭状态.将液体A滴入试管②与气体B充分反应后,打开夹子,发现试管①内的水立刻沸腾.A和B最不可能的一种组合是( )| A、A为NaOH溶液,B为CO2气体 |
| B、A为稀H2SO4溶液,B为NH3气体 |
| C、A为AgNO3溶液,B为HCl气体 |
| D、A为CaCl2溶液,B为CO2气体 |
 实验室需要配置一定浓度的硝酸钾溶液.
实验室需要配置一定浓度的硝酸钾溶液.
 如图是实验室制取气体的装置.请根据要求回答:
如图是实验室制取气体的装置.请根据要求回答:
 化学与生活、生产密切相关.请回答下列问题:
化学与生活、生产密切相关.请回答下列问题: