题目内容
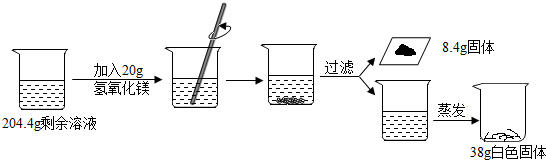
5.回收利用是保护金属资源的一条有效途径,某工业废料含氧化铜和氧化铁,经过处理后可得到铜和硫酸亚铁溶液.主要流程如图:
已知:CuO+H2SO4═CuSO4+H20 Fe+Fe2(SO4)3═3FeSO4
(1)流程Ⅰ中氧化铁发生反应的化学方程式是Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.
(2)流程Ⅲ充分反应后,还应有的实验操作是过滤.
(3)A-E中,含有铁、铜两种元素的是AC(填字母).
分析 (1)流程Ⅰ中氧化铁与过量的稀硫酸反应生成硫酸铁和水,写出反应的化学方程式即可.
(2)流程Ⅲ充分反应后,应将固体与液体分离,进行分析解答.
(3)根据A-E中的元素组成,判断是否含有铁、铜两种元素即可.
解答 解:(1)流程Ⅰ中氧化铁与过量的稀硫酸反应生成硫酸铁和水,反应的化学方程式是Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.
(2)流程Ⅲ充分反应后,应将固体与液体分离,还应有的实验操作是过滤.
(3)某工业废料含氧化铜和氧化铁,A是与硫酸反应生成的硫酸铜和硫酸铁的混合物,B是铁,铁与硫酸铜溶液反应生成硫酸亚铁溶液和铜,Fe+Fe2(SO4)3═3FeSO4
,则固体C为铜和过量的铁的混合物;加入适量的稀硫酸,铁与稀硫酸反应生成硫酸亚铁溶液,D为铜,E为硫酸亚铁溶液;则A-E中,含有铁、铜两种元素的是A.
故答案为:(1)Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;(2)过滤;(3)AC.
点评 本题难度不大,理解处理的主要流程图、熟练掌握酸的化学性质、金属的化学性质等并能灵活运用是正确解答本题的关键.

练习册系列答案
 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
13.用石灰浆涂抹墙壁,一段时间以后,涂层表面物质的pH小于其内层物质的pH.下列化学方程式可以解释这一现象的是( )
| A. | CaO+H2O=Ca(OH)2 | B. | Ca(OH)2+CO2=CaCO3↓+H2O | ||
| C. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | 2HCl+Ca(OH)2=CaCl2+2H2O |
20.运用所学的化学知识鉴别一些物质是化学中的重要应用,鉴别下列各组物质所加的试剂(括号内的物质)不正确的是( )
| A. | 硝酸铵固体 氢氧化钠固体(水) | B. | 氯化钠晶体 碳酸钠(稀盐酸) | ||
| C. | 一氧化碳 二氧化碳(灼热的铜) | D. | 黄金 锌铜合金(稀硫酸) |
10.空气的成分中能使酥脆的饼干变软的是( )
| A. | 氮气 | B. | 氧气 | C. | 稀有气体 | D. | 水蒸气 |
17.下列有关NaOH的实验方案中,正确的是( )
| A. | 用NaOH固体干燥CO2气体 | |
| B. | 用酚酞溶液检验NaOH溶液是否变质 | |
| C. | 用熟石灰和纯碱为原料制取NaOH | |
| D. | 用CaCl2溶液除去NaOH溶液中的少量Na2CO3 |
14.以甲为原料合成化工产品丁的微观过程如图.下列说法正确的是( )


| A. | 乙、丁为氧化物 | |
| B. | 转化①中乙和丙的分子个数之比为1:1 | |
| C. | 甲中氢元素的质量分数小于丁 | |
| D. | 该过程体现无机物与有机物可相互转化 |
15.农业上改良酸性土壤,应在土壤中施加适量的( )
| A. | 硫酸 | B. | 盐酸 | C. | 氢氧化钠 | D. | 熟石灰 |
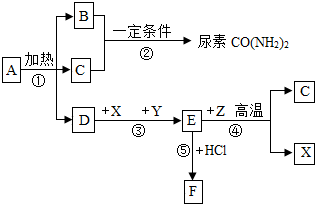 如图表示某些物质间转化关系.A为不含金属元素的盐,可作化肥,X是常见金属,B、C、Y、Z为气体,且B有刺激性气味,F为棕黄色溶液.
如图表示某些物质间转化关系.A为不含金属元素的盐,可作化肥,X是常见金属,B、C、Y、Z为气体,且B有刺激性气味,F为棕黄色溶液.