题目内容
2.取一定质量的CaCO3高温加热一段时间后,冷却,测得剩余固体的质量为8.0g,剩余固体中钙元素质量分数为50.0%.下列判断正确的是( )| A. | 原来CaCO3的质量为14.3 g | B. | 生成2.0 g CO2气体 | ||
| C. | 生成了5.6 g CaO | D. | 剩余CaCO3的质量为3.0 g |
分析 根据碳酸钙分解的化学方程式:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,结合质量守恒定律可以知道,在反应前后钙元素的质量相等,所以反应后剩余物质中钙元素的质量即为反应前碳酸钙中钙元素的质量,可以据此结合化学方程式进行解答.
解答 解:根据题意可以知道钙元素的质量为:8.0g×50.0%=4.0g,所以反应前碳酸钙的质量为:4.0g÷$\frac{40}{40+12+16×3}$×100%=10.0g,
根据质量守恒定律可以知道生成二氧化碳的质量为:10.0g-8.0g=2.0g;
设生成氧化钙的质量为x,消耗碳酸钙的质量为y
CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
100 56 44
y x 2.0g
$\frac{100}{y}$=$\frac{56}{x}$=$\frac{44}{2g}$
x=2.55g
y=4.55g
A、根据上述分析可以知道原来碳酸钙的质量为10g,故A错误;
B、根据质量守恒定律可以知道生成二氧化碳的质量为:10.0g-8.0g=2.0g,故B正确;
C、根据计算可以知道生成氧化钙的质量为2.55g,故C错误;
D、根据计算可以知道剩余的碳酸钙的质量为10.0g-4.55g=5.45g,故D错误.
故选:B.
点评 本考点考查了根据化学方程式的计算,是中考计算题中经常出现的题型.做题时要注意:化学方程式要写正确,始终不要忘记质量守恒定律,还要记牢“遇到差值要想气体”.

练习册系列答案
相关题目
7.通过下列实验可以得出的结论,其中不合理的是( )


| A. | 甲实验中黄铜片能在铜片上刻画出痕迹,可以说明黄铜的硬度比铜片大 | |
| B. | 乙实验既可以说明分子在不停地运动着,又可以说明氨水能使酚酞变红 | |
| C. | 丙实验既可以说明二氧化碳易溶于水,又可以说明二氧化碳具有酸性 | |
| D. | 丁实验中铁丝剧烈燃烧,说明物质的燃烧还受氧气浓度因素的影响 |
11.对于一种物质的正确认识,也跟正确认识一个人一样,要有一分为二的观点,客观认识它的优缺点或它给我们带来的好处与坏处.下列相关描述中,其中属于氧气带来的坏处的是( )
| A. | 登山潜水供给呼吸 | B. | 气焊与切割中帮助燃烧 | ||
| C. | 钢铁生锈 | D. | 酒和醋的酿造中帮助发酵 |


 如图是酒精灯的火焰的示意图,请回答:
如图是酒精灯的火焰的示意图,请回答: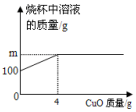 已知烧杯中装有100g硫酸和硫酸铜混合溶液,其中含硫酸铜2.4g.向烧杯中逐渐加入氧化铜,烧杯中溶液的质量与加入氧化铜的质量关系如图所示.请计算:
已知烧杯中装有100g硫酸和硫酸铜混合溶液,其中含硫酸铜2.4g.向烧杯中逐渐加入氧化铜,烧杯中溶液的质量与加入氧化铜的质量关系如图所示.请计算: