题目内容
13.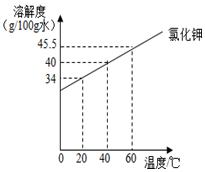 根据下表实验,回答相关问题
根据下表实验,回答相关问题| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 在盛有100g水的烧杯中,加入25g氯化钾,搅拌,恢复到20℃. | 全部溶解 |
| Ⅱ | 再加Xg氯化钾,搅拌,恢复到20℃,恰好饱和. | 全部溶解 |
| Ⅲ | 再加6g氯化钾,搅拌,恢复到20℃ | 固体不溶 |
| Ⅳ | 加热 | 全部溶解 |
| Ⅴ | 冷却至20℃ | 有固体析出 |
②实验步骤Ⅲ中所得溶液是饱和(填“饱和”或“不饱和”)溶液.
③冷却至20℃,烧杯中的现象是有固体析出.
④有五瓶氯化钾溶液,与上述实验步骤Ⅰ-Ⅴ形成的溶液溶质质量分数分别相等,现各取10g于5个小烧杯中,分别滴入足量的等质量等浓度的硝酸银溶液,其中有3个小烧杯中产生的沉淀质量相等.
分析 ①根据20℃氯化钾的溶解度考虑;②饱和溶液再加入溶质,不再溶解,固体不溶解,仍然是饱和溶液考虑;③冷却至20℃,烧杯中的现象是有固体析出;④根据溶质质量分数相等的溶液中加入硝酸银后生成沉淀质量相等考虑.
解答 解:①20℃氯化钾的溶解度考虑是34g,100g水中最多溶解34g,已经加入了25g,所以还需加入34g-25g=9g;
②饱和溶液再加入溶质,不再溶解,固体不溶解,说明是饱和溶液;
③冷却至20℃,此时已经加入了40g氯化钾,最多溶解34g,所以烧杯中的现象是有固体析出;
④溶质质量分数相等的溶液中加入硝酸银后生成沉淀质量相等,根据上面的分析可知,Ⅱ、Ⅲ、Ⅴ都是饱和溶液,溶质质量分数相等.
故答案为:①9;②饱和;③有固体析出;④3.
点评 解答本题关键是熟悉饱和溶液与不饱和溶液的转化方法.

练习册系列答案
相关题目
4.下列各组物质间能发生化学反应的是( )
| A. | 银和稀盐酸 | B. | 铁和硫酸锌溶液 | ||
| C. | 硝酸钾溶液和食盐水 | D. | 硫酸和氯化钡溶液 |
18.如表列出了除去物质中所含少量杂质的方法,其中错误的是( )
| 选项 | 物质 | 杂质 | 除杂方法 |
| A | CO2 | CO | 点燃 |
| B | MnO2粉 | C粉 | 在空气中充分灼烧 |
| C | FeSO4溶液 | CuSO4溶液 | 加入足量的铁粉,过滤 |
| D | NaCl固体 | 泥沙 | 溶解、过滤 |
| A. | A | B. | B | C. | C | D. | D |
5.已知金属X与CuSO4反应的化学方程式为2X+CuSO4═X2SO4+Cu,下列说法中不正确的是( )
| A. | 该反应为置换反应 | |
| B. | 金属X在金属活动性顺序表里一定在Cu前面 | |
| C. | 金属X可能是Fe | |
| D. | 反应前后,硫元素的化合价没有发生改变 |
2.如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是( )


| A. | 甲的溶解度大于乙 | |
| B. | 50℃时,将25g乙加入50g水中,可形成75g溶液 | |
| C. | 将50℃时甲的溶液降温至40℃,一定会析出晶体 | |
| D. | 将60℃的甲、乙、丙三种物质的饱和溶液降温至0℃,所得溶液中溶质质量分数由大到小的顺序为乙>甲>丙 |
3.归纳与反思是学习化学的重要环节,下列各项归纳完全正确的一组是( )
| A、对性质和用途的认识 | B、资源的利用和保护 |
| ①一氧化碳有可燃性,可用于冶炼金属 ②石墨很软,可以制成电极 | ①爱护水资源要节约用水和防止水体污染 ②保护金属资源只能通过防止金属腐蚀实现 |
| C、“生活中安全”的措施 | D、用“化学”眼光分析 |
| ①在室内一盆水能防止煤气中毒 ②夜间发现液化气泄漏开灯寻找泄漏源 | ①洗涤剂去油污是因为起乳化作用 ②湿衣服晾干是因为分子不断运动 |
| A. | A | B. | B | C. | C | D. | D |