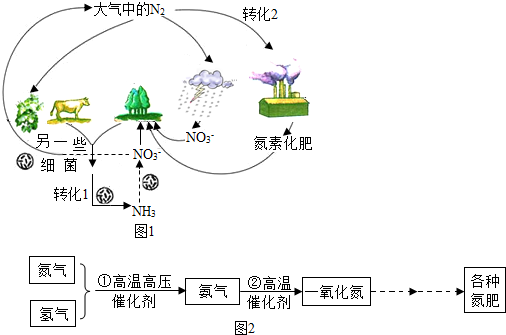
题目内容
19.化学与生活密切相关.(1)草木灰是一种农家肥料,有效成分是碳酸钾(K2CO3),草木灰属于钾(填“磷”或“钾”)肥.
(2)测得某地土壤酸碱度的pH为4.5,下列作物适合在该地区种植的是茶树;若要种植玉米,需要施用熟石灰降低土壤酸性.
| 作物 | 小麦 | 玉米 | 茶树 | 西瓜 | 萝卜 |
| 适宜生长的pH | 5.5-6.5 | 6.5-7.0 | 4.0-6.5 | 5.0-7.0 | 7.0-7.5 |
(4)当身体某些部位发生磕碰或出现伤口时,可以先用冷敷袋进行处理,冷敷袋中有一层很薄的膜将水与一种固体分开,使用时挤压包装袋即可将两种物质混合,下列物质适合做冷敷袋中固体物质的是B(填字母序号).
A、NaHCO3 B、NH4NO3 C、NaOH
(5)在汽车电路中,经常用铜作导线,这是利用了铜的延展性和导电性.
(6)铝抗腐蚀性能好,是因为铝与氧气反应,在其表面生成一层致密的氧化铝薄膜,氧化铝的化学式为Al2O3.
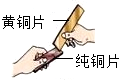
(7)黄铜是铜锌合金,将纯铜片和黄铜片相互刻画(如图所示),纯铜片上留下明显的划痕,说明黄铜的硬度比纯铜的大.
(8)自然界中的水需净化后饮用,活性炭常用于净化水,其主要作用是吸附.
(9)啤酒酿造需要大量的软水,生活中常用肥皂水区别软水和硬水.
(10)水常用于灭火,其灭火原理是隔绝氧气并降温至着火点以下.
分析 (1)含有氮元素的肥料称为氮肥,含有磷元素的肥料称为磷肥,含有钾元素的肥料称为钾肥.同时含有氮、磷、钾三种元素中的两种或两种以上的肥料称为复合肥,据此分析.
(2)根据土壤酸碱度的pH为4.5,和表格中的作物最适宜的pH范围做出判断.
(3)根据物质间反应时是否放热判断;
(4)根据“可用于冷敷”说明水和该物质混合吸收热量.有的物质溶于水时会放出热量,使溶液温度升高,如浓硫酸、氢氧化钠等;也有些物质溶于水时会吸收热量,使溶液温度降低,如硝酸铵解答.
(5)根据铜具有良好的延展性和导电性分析;
(6)根据氧化铝的写法考虑;
(7)根据合金比组成成分金属的硬度大考虑.
(8)根据活性炭具有吸附性分析回答;
(9)根据区别软水和硬水的方法分析回答;
(10)根据灭火的原理分析回答.
解答 解:(1)碳酸钾(K2CO3)中含有钾元素,属于钾肥.
(2)土壤酸碱度的pH为4.5,茶树适宜生长的pH范围是4.0~6.5,所以适于种植茶树;适于玉米生长的pH范围是6.5~7.0,若要种植玉米就要降低土壤的酸性,可施用熟石灰降低土壤的酸性.
(3)生石灰与水反应放出大量的热,利用其放出的热量可对食物进行加热;反应的化学方程式为:CaO+H2O═Ca(OH)2;
(4)A、NaHCO3 溶于水时,溶液温度变化不大,故错.
B、硝酸铵晶体溶于水时吸收热量;故对.
C、氢氧化钠溶水时放出热量;故错.
(5)铜能制作导线,这是利用了金属铜的延展性和导电性;
(6)铝显+3价,氧显-2价,所以氧化铝的化学式是Al2O3;
(7)合金比组成成分金属的硬度大,所以黄铜是铜锌合金,将纯铜片和黄铜片相互刻画(如右图所示),纯铜片上留下明显的划痕,说明黄铜的硬度比纯铜的大.
(8)由于活性炭具有吸附性,自然界中的水需净化后饮用,活性炭常用于净化水,其主要作用是吸附.
(9)啤酒酿造需要大量的软水,生活中常用肥皂水区别软水和硬水,遇肥皂水产生的泡沫少的是硬水,遇肥皂水产生的泡沫多的是软水.
(10)水常用于灭火,其灭火原理是隔绝氧气并降温至着火点以下.
故答案为:(1)钾.
(2)茶树;熟石灰.
(3)CaO+H2O═Ca(OH)2.
(4)B.
(5)导电性,.
(6)Al2O3.
(7)黄铜的硬度比纯铜的大.
(8)吸附;
(9)肥皂水;
(10)隔绝氧气并降温至着火点以下.
点评 本题考查的知识点较多,但难度不大,细心解答即可.

| A. | 氮气 | B. | 氢气 | C. | 二氧化碳 | D. | 氧气 |
| 物质 | A | B | C | D |
| 反应前质量g | 2 | 24.5 | 2 | 1 |
| 反应后质量g | 16.9 | 0 | 2 | 未知 |
(2)该反应的类型是分解反应(填分解反应或化合反应).
(1)请写出维生素C所属类别有机物(有机物、无机物).
(2)某同学设计了下列实验来证明维生素C药片中含有碳元素.请你完成下列空白处的实验报告:
| 实验操作步骤 | 实验现象 | 结论 |
| 用坩埚钳夹持一片维生素C药片放在酒精灯上灼烧 | 药片变黑 | 维生素C药片中含有碳元素 |
(4)若配制质量分数为10%维生素C注射液100g,需要水的质量为90g.
| 选项 | 物质 | 杂质 | 除杂所用试剂和方法 |
| A | MnO2固体 | KCl固体 | 加水溶解、过滤、蒸发结晶 |
| B | NaOH溶液 | Ca(OH)2溶液 | 先加入过量的Na2CO3溶液,再过滤 |
| C | NaCl溶液 | Na2CO3溶液 | 加入澄清石灰水,过滤 |
| D | CaCl2固体 | CaCO3固体 | 加入过量的稀盐酸,蒸发 |
| A. | A | B. | B | C. | C | D. | D |
【提出问题】石蜡中除含碳、氢元素外,是否还含有氧元素?
【实验设计】根据质量守恒定律,该同学用精制石蜡、棉线烛芯做成蜡烛,设计了如下实验(其中浓硫酸、无水硫酸铜均易吸收水分,药品用量保证充足,部分固定装置省略).

【操作原理】
(1)请写出A装置(含导气管)气密性的检查方法:先关闭分液漏斗的活塞,将导气管一端放入水中,用手紧握烧瓶,若导管口有气泡产生,则装置气密性良好,反之,则不好.装置A中发生反应的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)装置B的作用是干燥氧气;装置D的作用是确保不完全燃烧的一氧化碳及碳全部转化为二氧化碳.
(3)装置F发生反应的化学方程式是2NaOH+CO2═Na2CO3+H2O.
(4)为达到实验目的,反应前、后必须称量CEF(填装置序号)装置中的药品质量.
【数据处理】
(5)该同学在老师帮助下,经过一些补充实验和误差处理后得出了如下数据,请你帮助完成数据分析及结论部分.
| 实验事实 | 数据分析及结论 |
| 2.12g石蜡完全燃烧,得到6.6g CO2和2.88g H2O | 写出计算过程: 结论:石蜡中不含氧元素. |
(6)根据该学生设计的实验,你认为造成误差的原因是装置内残留的空气含有水和二氧化碳或棉线烛芯燃烧也会产生水和二氧化碳或未完全燃烧的石蜡蒸气、碳黑残留在导管内或未进行多次重复实验等(填写一条).
(7)针对你提出的误差原因,提出减少误差的实验或改进措施:实验前先通氧气将装置内的空气赶尽或取相同规格的棉线烛芯代替蜡烛,做相同的实验,然后扣除相应的数据或进行多次重复实验取平均值等.