题目内容
5.50g的锌片放入200g溶质的质量分数为18.25%的盐酸溶液中,完全反应后,锌有剩余.求:(1)生成氢气的质量.
(2)反应后所得溶液的质量.
(3)反应后所得溶液的溶质质量分数.
分析 (1)根据锌和稀盐酸反应生成氯化锌和氢气,依据稀盐酸的质量进行计算;
(2)根据质量守恒定律计算反应后所得溶液的质量;
(3)根据化学方程式计算反应后溶质的质量,依据(2)中溶液的质量进行计算.
解答 解:参加反应的稀盐酸的质量为:200g×18.25%=36.5g,
设生成氢气的质量为x,生成氯化锌质量为y,参加反应的锌的质量为z
Zn+2HCl═ZnCl2+H2↑
65 73 136 2
z 36.5g y x
$\frac{65}{z}$=$\frac{73}{36.5g}$=$\frac{136}{y}$=$\frac{2}{x}$
x=1g
y=68g
z=32.5g
(1)生成氢气的质量为1g;
(2)反应后所得溶液的质量为:32.5g+200g-1g=231.5g;
(3)反应后所得溶液的溶质质量分数为:$\frac{68g}{231.5g}$×100%=29.4%.
故答案为:(1)1g;
(2)231.5g;
(3)29.4%.
点评 本题主要考查了化学方程式的计算,难度不大,注意解题的规范性和准确性.

练习册系列答案
相关题目
16.实验设计是化学实验的重要环节.请根据下列实验要求回答相关问题:
【活动与探究一】用对比实验方法探究二氧化碳的性质.
(1)实验一中振荡3个矿泉本塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O;;对比A瓶与C(填“B”或“C”)瓶的实验现象,可证明CO2能与NaOH发生反应.
(2)实验二观察到C装置中发生的现象是干燥的石蕊试纸无变化,湿润的蓝色石蕊试纸变红色结论是CO2+H2O=H2CO3(用化学方程式表示).
【活动与探究二】用变量控制方法探究影响物质溶解性的因素.
(3)实验三目的是探究温度;对硝酸钾溶解性的影响;实验四是探究溶剂种类对物质溶解性的影响,该实验中需要控制的变量是温度和溶质、溶剂的质量相等
【活动与探究三】定量测定空气中氧气的含量.
(4)实验五中,反应的原理为2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO(用化学方程式表示);装置一比装置二更合理,理由是装置一中氧气反应的更充分
根据下表提供的实验数据,完成表:
定量实验操作中易产生误差,如果反应前气球中存在气体(其量小于注射器内的空气),而实验后冷却至室温,将气球内的气体全部挤出读数,导致实验测得结果偏小(填“偏小、‘偏大”或“无影响”).
【活动与探究一】用对比实验方法探究二氧化碳的性质.
| 实验一 | 实验二 |
 |  |
(2)实验二观察到C装置中发生的现象是干燥的石蕊试纸无变化,湿润的蓝色石蕊试纸变红色结论是CO2+H2O=H2CO3(用化学方程式表示).
【活动与探究二】用变量控制方法探究影响物质溶解性的因素.
| 实验三 | 实验四 |
 |  |
【活动与探究三】定量测定空气中氧气的含量.
| 实验五 | |
 |  |
根据下表提供的实验数据,完成表:
| 硬质玻璃管 的容积 | 反应前注射器中 气体体积 | 反应后注射器中气体体积 | 实验测得空气中氧气 的体积分数 |
| 30mL | 20mL | 12mL |
13.如图表示治理汽车尾气所涉及反应的微观过程.下列说法正确的是( )

| A. | 图中涉及的物质均为氧化物 | B. | 反应物和生成物均含有毒气体 | ||
| C. | 生成单质与化合物的质量比为7:22 | D. | 生成物的分子个数比为1:1 |
17.下列对化学用语的认识正确的是( )
| A. | N2表示2个氮原子 | |
| B. | Ca2+表示一个钙元素带2个单位的正电荷 | |
| C. | H2CO3中碳元素的化合价为+4价 | |
| D. | 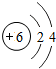 和 和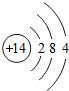 属于同种元素 属于同种元素 |
14.实验室四瓶失去标签的无色溶液分别为氯化钠溶液、稀盐酸、氢氧化钠溶液和稀硫酸.以下说法正确的是( )
| A. | 打开试剂瓶塞就可以判断出稀盐酸--瓶口有“白雾” | |
| B. | 观察试剂瓶的瓶塞可以判断出氢氧化钠溶液--是胶塞 | |
| C. | 打开试剂瓶塞尝味道可以判断出氧化钠溶液--有咸味 | |
| D. | 将pH试纸伸入试剂瓶中可以判断出稀硫酸--pH小于7 |
15.物质的性质决定物质的用途.下列物质的用途中,主要利用其物理性质的是( )
| A. | 天然气用来作燃料 | B. | 二氧化碳用来作灭火 | ||
| C. | 干冰用作制冷剂 | D. | 氮气用作焊接金属的保护气 |
 (1)下列实验均涉及到水,其中水仅作为溶剂的是AC;
(1)下列实验均涉及到水,其中水仅作为溶剂的是AC;
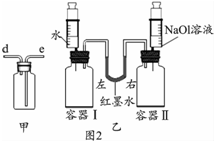
 (1)某同学在探究“酸与碱能否发生反应”时,用稀NaOH溶液、稀盐酸和某种酸碱指示剂进行实验的过程见图. 如图所加试剂①②分别是氢氧化钠溶液、酚酞(指明具体物质的名称)
(1)某同学在探究“酸与碱能否发生反应”时,用稀NaOH溶液、稀盐酸和某种酸碱指示剂进行实验的过程见图. 如图所加试剂①②分别是氢氧化钠溶液、酚酞(指明具体物质的名称)