题目内容
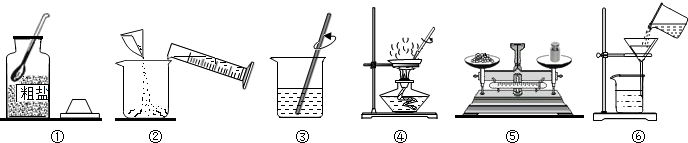
6. 向amolFe2O3中滴加稀硫酸,随着硫酸的加入,有关量的变化见图,分析错误的是( )
向amolFe2O3中滴加稀硫酸,随着硫酸的加入,有关量的变化见图,分析错误的是( )| A. | 曲线甲表示氧化铁的物质的量 | |
| B. | 曲线乙表示生成水的物质的量 | |
| C. | K点时溶液中铁元素的物质的量是amol | |
| D. | K点时硫酸铁和剩余氧化铁物质的量相等 |
分析 根据向氧化铁中加入稀硫酸,发生反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,结合图象分析解答;
解答 解:向氧化铁中加入稀硫酸,发生反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,
A、向氧化铁中加入稀硫酸,发生反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.氧化铁质量不断减少,反应完毕,氧化铁质量为0,曲线甲表示氧化铁的物质的量,故正确;
B、向amolFe2O3中滴加稀硫酸,随着硫酸的加入,水的物质的量不断增加,不会出现平线,故错误;
C、由Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
1 3
0.5mol 1.5mol
由图象可知:amolFe2O3中铁元素的物质的量是2amol,K点时氧化铁被消耗0.5amol,溶液中铁元素的物质的量是amol,故正确;
D、K点时氧化铁被消耗0.5mol,溶液中铁元素的物质的量是amol,剩余氧化铁物质的量为0.5amol×2=amol,点时硫酸铁和剩余氧化铁物质的量相等,故正确.
答案:B
点评 本题考查混合物有关计算,难度中等,清楚反应过程是解题关键,注意利用总反应方程式解答,侧重对学生思维能力考查.

练习册系列答案
相关题目
16.下列有关水的说法正确的是( )
| A. | 过滤可使硬水转化为软水 | |
| B. | 活性炭能使海水转化为淡水 | |
| C. | 为防止水体污染,应禁止使用化肥和农药 | |
| D. | 天然水中加入明矾做絮凝剂,可吸附水中的难溶性杂质 |
1.下列化肥属于含磷复合肥料的是( )
| A. | NH4NO3 | B. | KNO3 | C. | (NH4)2HPO4 | D. | Ca(H2PO4)2 |
18.控制变量是化学实验中常用的一种研究方法.下列实验方案设计不合理的是( )
| A. | 用两个相同型号的塑料瓶各收集一瓶氧气和二氧化碳,再分别注入等量的水,旋紧瓶盖,振荡,通过观察塑料瓶变瘪的程度,比较氧气和二氧化碳在水中溶解度性的强弱 | |
| B. | 用等体积等质量分数的双氧水和不同质量的二氧化锰混合,测定收集相同体积氧气所需要的时间,探究催化剂用量对反应速率的影响 | |
| C. | 取等体积不同地区的两种天然水,分别加入不同体积的同种肥皂水,振荡.观察产生泡沫的多少,比较两种天然水中Ca2+、Mg2+含量的高低 | |
| D. | 在相同规格的烧杯中分别加入等体积的热水和冷水,分别在其中加一滴红墨水,比较红墨水在水中的扩散速率,探究温度对分子运动速率的影响 |
16.下列化学用语与含义相符的是( )
| A. | 3H-3个氢元素 | B. | O-1个氧分子 | C. | Na-1个钠原子 | D. | Mg+2-1个镁离子 |

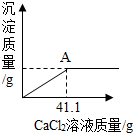 某化学课外活动兴趣小组的同学,多某化工产生产的纯碱样品(已知杂质只含氯化钠)的纯度产生了兴趣,设计实验并探究如下:①取一定质量的该样品,加55.65g水配成溶液;②向溶液中逐渐加入一定质量分数的CaCl2溶液(实验中产生的沉淀与加入CaCl2溶液的质量关系如图所示),当反应至A点时恰好完全反应;③过滤,测得所得滤液为100g14.35%的氯化钠溶液(实验过程中水的损失忽略不计).试求:
某化学课外活动兴趣小组的同学,多某化工产生产的纯碱样品(已知杂质只含氯化钠)的纯度产生了兴趣,设计实验并探究如下:①取一定质量的该样品,加55.65g水配成溶液;②向溶液中逐渐加入一定质量分数的CaCl2溶液(实验中产生的沉淀与加入CaCl2溶液的质量关系如图所示),当反应至A点时恰好完全反应;③过滤,测得所得滤液为100g14.35%的氯化钠溶液(实验过程中水的损失忽略不计).试求: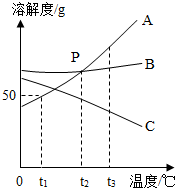 A,B,C三种固体物质的溶解度曲线如图所示,回答下列问题:
A,B,C三种固体物质的溶解度曲线如图所示,回答下列问题: