题目内容
2. 为测定某BaCl2溶液的溶质质量分数,取100g该BaCl2溶液,不断加入稀H2SO4,反应过程中溶液质量与加入稀H2SO4的质量关系如图所示.
为测定某BaCl2溶液的溶质质量分数,取100g该BaCl2溶液,不断加入稀H2SO4,反应过程中溶液质量与加入稀H2SO4的质量关系如图所示.①P点表示的意义是稀硫酸和氯化钡恰好完全反应.
②完成反应的化学方程式:BaCl2+H2SO4=BaSO4↓+2HCl.
③求原BaCl2溶液的溶质质量分数(写出计算过程).
分析 ①根据坐标的变化分析P点的意义;
②根据质量守恒定律分析;
③根据质量守恒定律及图信息示求出生成沉淀硫酸钡的质量;
根据化学方程式,列出比例式求出氯化钡的质量,再根据溶质质量分数的公式计算溶质质量分数.
解答 解:①坐标的起点100g是氯化钡溶液的质量,随着稀硫酸的加入,产生硫酸钡的同时,溶液逐渐增加,等到完全反应时,由于没有沉淀的产生,所以溶液的质量的斜率变大;
②根据质量守恒定律反应前后原子的种类和数目不变,可知反应前有1个钡原子,2个氯原子,2个氢原子,1个硫酸根离子,反应后有1个钡原子,1个硫酸根离子,所以空格处有2个氯原子,2个氢原子,所以为2HCl;
③根据质量守恒定律:100g+100g-176.7g=23.3g是硫酸钡沉淀的质量;
设BaCl2质量为x
BaCl2+H2SO4=BaSO4↓+2HCl
208 233
x 23.3g
$\frac{208}{x}=\frac{233}{23.3g}$
x=20.8g
原BaCl2溶液的溶质质量分数为:$\frac{20.8g}{100g}×100%$=20.8%;
答:原BaCl2溶液的溶质质质量分数为20.8%.
答案:①稀硫酸和氯化钡恰好完全反应; ②2HCl; ③20.8%.
点评 根据化学方程式进行计算的步骤一般为设出未知数,写出配平的化学方程式,求出相关物质的质量比,列出比例式,求解,答,共六步.

练习册系列答案
相关题目
4.下列人体所必需的元素中,摄入不足易得贫血症的是( )
| A. | 铁 | B. | 碘 | C. | 钙 | D. | 锌 |
7.下列知识整理的内容中,均正确的一组是( )
| A.物质的鉴别 | B.物质的除杂 |
| 固体(氢氧化钠、氯化钠)--水 溶液(氢氧化钠、盐酸)--酚酞溶液 | 氯化钠中混有少量硫酸铜杂质--氢氧化钡 CO2混有少量CO杂质--点燃 |
| C.物质的用途 | D.物质的分类 |
| 小苏打、碳酸钙--治疗胃酸过多 烧碱、熟石灰--改良酸性土壤 | 纯碱、火碱--碱类 铁、锌、钙元素--人体必需的微量元素 |
| A. | A | B. | B | C. | C | D. | D |
11.下列说法正确的是( )
| A. | 由同一种元素组成的物质一定是单质 | |
| B. | 水常用于灭火,是因为降低了可燃物的着火点 | |
| C. | 在同一种物质中同种元素的化合价可能不相同 | |
| D. | 分子、原子都是不带电的微粒.所以不带电的微粒一定是分子或原子 |
12.甲、乙两种固体的溶解度曲线如图所示.下列说法中,不正确的是( )


| A. | 20℃时,甲、乙两溶液中溶质的质量分数相等 | |
| B. | 40℃时,分别在100 g水中加入50 g 甲、乙,所得溶液中甲的质量分数更大 | |
| C. | 将20℃甲、乙的饱和溶液分别升温到40℃,两溶液中溶质的质量分数相等 | |
| D. | 20℃时,分别在100 g水中加入40 g 甲、乙,加热到40℃时,乙溶液为饱和溶液 |
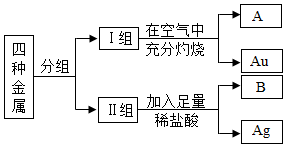 某课外活动小组的同学在老师的帮助下从废弃家电中获得了铁(Fe)、铜(Cu)、银(Ag)、金(Au)四种金属.如何区分这四种金属呢?同学们进行如下实验:
某课外活动小组的同学在老师的帮助下从废弃家电中获得了铁(Fe)、铜(Cu)、银(Ag)、金(Au)四种金属.如何区分这四种金属呢?同学们进行如下实验: 化学与生活、科技、环境密切相关.
化学与生活、科技、环境密切相关.