题目内容
9.小明为探究石灰石所含碳酸钙的质量分数,称取13g石灰石样品,加入100g足量的稀盐酸放入烧杯中,充分反应后,烧杯中剩余物质量为110.6g,请计算:已知:CaCO3+2HCl═CaCl2+CO2↑+2H2O(1)根据质量守恒定律,生成二氧化碳的质量4.4克;
(2)此石灰石样品中碳酸钙的质量为多少克?
(3)这种石灰石样品中含碳酸钙的纯度是多少?
分析 碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳;13g石灰石(主要成分是碳酸钙)、100g足量的稀盐酸、烧杯中剩余物质量110.6g均为混合物的质量;由质量守恒定律,烧杯内质量的减少的质量即生成二氧化碳的质量,据此根据反应的化学方程式列式计算出参加反应的碳酸钙的质量,进而计算出石灰石样品中含碳酸钙的纯度.
解答 解:(1)根据质量守恒定律,生成二氧化碳的质量为13g+100g-110.6g=4.4g.
(2)设参加反应的碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
$\frac{100}{44}=\frac{x}{4.4g}$ x=10g
(3)这种石灰石样品中含碳酸钙的纯度是$\frac{10g}{13g}×$100%≈76.9%.
答:(1)4.4;(2)此石灰石样品中碳酸钙的质量为10g;(3)这种石灰石样品中含碳酸钙的纯度是76.9%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出二氧化碳的质量是正确解答本题的前提和关键.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
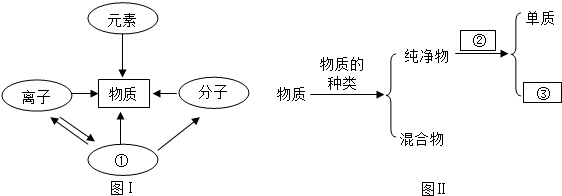
19.氮化硅(Si3N4)是一种新型陶瓷材料的主要成分.氮化硅属于( )
| A. | 单质 | B. | 化合物 | C. | 氧化物 | D. | 混合物 |
20.下列变化过程中,属于化学变化的是( )
| A. | 百炼成钢 | B. | 石油分馏 | C. | 玉石摔碎 | D. | 滴水成冰 |
4.红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图1所示.
同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究.
【提出问题】久置固体的成分是什么?
【查阅资料】铁与氯化铁溶液在常温下发生反应生成氯化亚铁.
【作出猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3
【实验探究】甲同学的方案:
乙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色,并设计如图2实验方案继续验证.
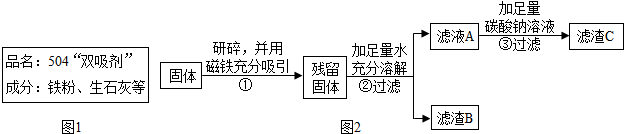
②中固体溶解时放出大量热,由此可以判断固体中一定含有CaO.乙同学对滤渣B又进行探究.
同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究.
【提出问题】久置固体的成分是什么?
【查阅资料】铁与氯化铁溶液在常温下发生反应生成氯化亚铁.
【作出猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3
【实验探究】甲同学的方案:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体放于试管中,滴加足量的稀盐酸. | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液. | 固体中一定含有Fe,一定不含Fe2O3. |

②中固体溶解时放出大量热,由此可以判断固体中一定含有CaO.乙同学对滤渣B又进行探究.
| 实验操作 | 实验现象 | 实验结论 |
| ①取滤渣B于试管中,加入适量稀盐酸 ②将生成的气体通入澄清石灰水 | ①固体减少,有气泡冒出,溶液变为黄色. ②澄清石灰水变浑浊 | 固体中一定含有CaCO3 和Fe2O3 |
7.梳理化学知识,能使你头脑更聪明.以下完全正确的一组是( )
| A | 物质的性质与用途 | C | 安全常识 |
| N2性质稳定-填充食品袋防腐 O2支持燃烧-可作发射火箭燃料 | 进入深洞-用手电筒做灯火试验 天然气泄漏-关闭阀门,开窗通风 | ||
| B | 日常生活经验 | D | 构成物质的基本微粒 |
| 生活中硬水软化-煮沸 电视机着火-用水扑灭 | 原子-由原子核和核外电子构成 阳离子-质子数>电子数 |
| A. | A | B. | B | C. | C | D. | D |