题目内容
4.红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图1所示.同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究.
【提出问题】久置固体的成分是什么?
【查阅资料】铁与氯化铁溶液在常温下发生反应生成氯化亚铁.
【作出猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3
【实验探究】甲同学的方案:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体放于试管中,滴加足量的稀盐酸. | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液. | 固体中一定含有Fe,一定不含Fe2O3. |
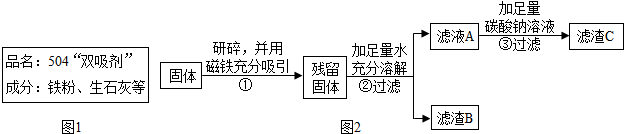
②中固体溶解时放出大量热,由此可以判断固体中一定含有CaO.乙同学对滤渣B又进行探究.
| 实验操作 | 实验现象 | 实验结论 |
| ①取滤渣B于试管中,加入适量稀盐酸 ②将生成的气体通入澄清石灰水 | ①固体减少,有气泡冒出,溶液变为黄色. ②澄清石灰水变浑浊 | 固体中一定含有CaCO3 和Fe2O3 |
分析 本题探究了防腐剂的成分,取少量固体放于试管中,滴加足量的稀盐酸,固体逐渐消失,有大量无色气体产生,得到浅绿色溶液,固体中一定含有铁,不一定不含Fe2O3理由是:氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色.由乙同学的设计方案可知:磁铁吸引了铁粉,②中固体溶解时放出大量热,因为生石灰溶于水生成熟石灰放出大量的热,由此可以判断固体中一定含有氧化钙;滤液A中的氢氧化钙和碳酸钠反应生成碳酸钙白色沉淀和氢氧化钠,配平即可;对滤渣B又进行探究:①取滤渣B于试管中,加入适量稀盐酸,固体减少,有气泡冒出,溶液变为黄色;②将生成的气体通入澄清石灰水,澄清石灰水变浑浊;固体中一定含有CaCO3和Fe2O3.
解答 解:甲同学的方案:取少量固体放于试管中,滴加足量的稀盐酸,固体逐渐消失,有大量无色气体产生,得到浅绿色溶液,固体中一定含有铁,故答案为:稀盐酸;Fe.
乙同学:不一定不含Fe2O3理由是:氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色.故答案为:理由:氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色.
(1)由乙同学的设计方案可知:磁铁吸引了铁粉,②中固体溶解时放出大量热,因为生石灰溶于水生成熟石灰放出大量的热,由此可以判断固体中一定含有氧化钙;故答案为:CaO
对滤渣B的探究:①取滤渣B于试管中,加入适量稀盐酸,固体减少,有气泡冒出,溶液变为黄色;②将生成的气体通入澄清石灰水,澄清石灰水变浑浊;固体中一定含有CaCO3和Fe2O3.
故答案为:
| 实验操作 | 实验现象 | 实验结论 |
| ①取滤渣B于试管中,加入适量稀盐酸. ②将生成的气体通入澄清石灰水. | ①固体减少,有气泡冒出,溶液变为黄色. ②澄清石灰水变浑浊. | 固体中一定含有CaCO3 和Fe2O3. |
点评 有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行,能否达到实验目的;二是设计的方法进行比较,那种方法更简便.本考点主要出现在实验题中.

| A. | c=a+b | B. | c=2b-a | C. | c=a+2 b | D. | c=2 a-b |
| A. | 化合反应一定只有一种生成物 | |
| B. | 有单质参加的反应一定是置换反应 | |
| C. | 分解反应一定有气体生成 | |
| D. | 生成两种化合物的反应一定是复分解反应 |
| A. | 氧气(O2)和臭氧(O3)都属于单质 | B. | 氧气(O2)和水(H2O)都属于氧化物 | ||
| C. | 火碱(NaOH)和纯碱(Na2CO3)都属于碱 | D. | 盐酸和氯化氢都是纯净物 |
①都是白色固体 ②都极易溶于水放出大量的热 ③溶液都能使无色酚酞试剂变红 ④都能与酸发生中和反应 ⑤溶液中通入CO2都变浑浊 ⑥溶液都能与Na2CO3溶液反应.
| A. | ①②⑤⑥ | B. | ①③④ | C. | ①④⑥ | D. | ③④ |
实验1:回收填料中的二氧化锰和氯化铵查阅资料:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水.兴趣小组的同学们设计回收物质的流程如图1所示.

(1)操作1和操作2的名称都是过滤,该操作中玻璃棒的作用是引流.
(2)灼烧滤渣l的目的是使炭粉和氧气反应转化成二氧化碳,从而和二氧化锰分离
实验2:利用外壳回收物锌制取氢气及相关探究
(3)用锌和稀硫酸制取氢气.己知氢气密度比空气小且难溶于水,提供装置如图2.
①应选择:发生装置为B(填编号),排空气法收集装置为D(填编号).
②若用排水法收集并测定气体的体积,气体从装置B导管口b(填“a”或“b”) 进;选用仪器F测量排出水的体积,仪器F名称是量筒.为了保证测定的准确,出水导管应放在仪器F的上端(填“上端”或“底端”).
(4)探究影响锌与稀硫酸反应快慢的因素.反应过程中,用前10min内收集的氢气体积比较反应的快慢.控制其他条件相同,进行下表四组实验,获得数据如表.
| 验实号编 | 试 剂 | 前 10min 内产生的氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和浓度的稀硫酸 | ||
| a | 纯锌 | 30mL 30% | 564.3 |
| b | 含杂质的锌 | 30mL 30% | 634.7 |
| c | 纯锌 | 30mL 20% | 449.3 |
| d | 纯锌 | 40mL 30% | 602.8 |
②为了研究硫酸浓度对反应快慢的影响,需比较实验a和c(填编号).
③控制其他条件相同,需控制的条件是锌的纯度(列举一种条件即可).
【实验4探究】经处理干净的二氧化锰在氯酸钾分解反应中的催化作用
(1)把干燥纯净的24.5g氯酸钾和5.5g二氧化锰混匀、装入大试管中,加热.
(2)待反应完全后,将试管冷却、称量,得到20.4g残留固体.
(3)再将残留固体经溶解、过滤、洗涤、干燥、称量,得到5.5g黑色固体.
【数据分析】
①该实验说明:二氧化锰在氯酸钾分解反应前后,质量不变.
②完全反应后制得氧气的质量是9.6g.(提示:已知所有化学反应遵循如下规律:参加化学反应的各物质的质量总和等于反应后各生成物的质量总和)
【实验反思】
要证明二氧化锰是氯酸钾分解反应的催化剂,还要做一个对比实验:将等质量的2份氯酸钾粉末,其中一份加入少量的上述实验所得二氧化锰混匀、装入试管,另一份装入另一试管,加热,比较反应速率的大小.
