题目内容
14.下列实验能直接用于验证质量守恒定律的是( )| A. | 镁条在空气中燃烧 | B. | 氢氧化钠溶液与硫酸铜溶液混合 | ||
| C. | 干冰放在密闭容器中加热 | D. | 稀盐酸滴加到盛放石灰石的烧杯中 |
分析 根据已有的知识进行分析解答,质量守恒定律是化学变化中物质质量的守恒,据此解答.
解答 解:A、镁条在空气中燃烧,是化学变化,能直接用于验证质量守恒定律;
B、氢氧化钠溶液与硫酸铜溶液混合,是化学变化,能直接用于验证质量守恒定律;
C、干冰放在密闭容器中加热是物理变化,不能直接用于验证质量守恒定律;
D、稀盐酸滴加到盛放石灰石的烧杯中发生的是化学变化,能直接用于验证质量守恒定律;
故选C.
点评 本题考查的是质量守恒定律的验证,完成此题的关键是抓住化学变化.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5. 某课外活动小组设计了如图所示的实验装置,用来研究不同金属跟稀硫酸反应的快慢.他们用此装置,选择了甲、乙、丙、丁四种大小相同的金属片,分别与相同体积、相同质量分数的稀硫酸反应,在30秒钟里观察从导管口冒出的氢气泡数量,记录在表中.(“+”越多表示产生的气泡越多)
某课外活动小组设计了如图所示的实验装置,用来研究不同金属跟稀硫酸反应的快慢.他们用此装置,选择了甲、乙、丙、丁四种大小相同的金属片,分别与相同体积、相同质量分数的稀硫酸反应,在30秒钟里观察从导管口冒出的氢气泡数量,记录在表中.(“+”越多表示产生的气泡越多)
(1)从实验结果看出,甲、乙、丙、丁四种金属与稀硫酸反应由快到慢的顺序是乙>丙>甲>丁;
(2)如果四种金属分别是镁、铝、铁、锌中的一种,则丁最有可能是铁.
 某课外活动小组设计了如图所示的实验装置,用来研究不同金属跟稀硫酸反应的快慢.他们用此装置,选择了甲、乙、丙、丁四种大小相同的金属片,分别与相同体积、相同质量分数的稀硫酸反应,在30秒钟里观察从导管口冒出的氢气泡数量,记录在表中.(“+”越多表示产生的气泡越多)
某课外活动小组设计了如图所示的实验装置,用来研究不同金属跟稀硫酸反应的快慢.他们用此装置,选择了甲、乙、丙、丁四种大小相同的金属片,分别与相同体积、相同质量分数的稀硫酸反应,在30秒钟里观察从导管口冒出的氢气泡数量,记录在表中.(“+”越多表示产生的气泡越多)| 金属 | 甲 | 乙 | 丙 | 丁 |
| 氢气泡数量 | ++ | ++++ | +++ | + |
(2)如果四种金属分别是镁、铝、铁、锌中的一种,则丁最有可能是铁.
9.下列与分子和原子相关的说法正确的是( )
| A. | 物质都是由分子构成的 | |
| B. | 分子间没有空隙 | |
| C. | 原子是化学变化中不能再分的微粒 | |
| D. | 在化学反应前后,分子的种类和数目都保持不变 |
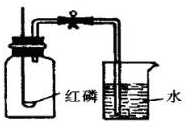 小明和小芳为了测定空气的组成,按如图进行实验:请你通过实验现象和题中信息,帮助他们完成下面的实验内容:
小明和小芳为了测定空气的组成,按如图进行实验:请你通过实验现象和题中信息,帮助他们完成下面的实验内容: