题目内容
32.5g锌可以跟200g硫酸溶液恰好完全反应.计算:
(1)这种硫酸溶液溶质的质量分数?
(2)能生成多少氢气?
(3)如果把溶液蒸干,能得到多少克固体?
(4)所得溶液的溶质质量分数是多少?
(1)这种硫酸溶液溶质的质量分数?
(2)能生成多少氢气?
(3)如果把溶液蒸干,能得到多少克固体?
(4)所得溶液的溶质质量分数是多少?
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:锌与硫酸恰好完全反应,反应后溶液为硫酸锌溶液,根据反应的化学方程式,由金属锌的质量计算生成氢气的质量、硫酸锌质量即溶液中溶质质量,硫酸溶液中溶质的质量;根据上述计算,利用溶质质量分数公式计算稀硫酸溶液的质量分数;根据质量守恒定律,首先求出硫酸锌溶液的质量,再由溶质质量分数公式计算稀硫酸锌溶液的质量分数.
解答:解:(1)设反应放出氢气质量为x,生成硫酸锌质量为y,消耗硫酸质量为z.
Zn+H2SO4=ZnSO4+H2↑
65 98 161 2
32.5g z y x
=
x=1g
=
y=80.5g
=
z=49g
这种硫酸溶液溶质的质量分数=
×100%=24.5%
(2)生成氢气的质量为1g;
(3)如果把溶液蒸干,能得到固体是硫酸锌,所以固体的质量为80.5g;
(4)所得溶液的溶质质量分数=
×100%≈34.8%
答:(1)这种硫酸溶液溶质的质量是24.5%;
(2)生成氢气的质量为1g;
(3)如果把溶液蒸干,能得到80.5固体;
(4)所得溶液的溶质质量分数是34.8%.
Zn+H2SO4=ZnSO4+H2↑
65 98 161 2
32.5g z y x
| 65 |
| 32.5g |
| 2 |
| x |
x=1g
| 161 |
| y |
| 65 |
| 32.5g |
y=80.5g
| 65 |
| 32.5g |
| 98 |
| z |
z=49g
这种硫酸溶液溶质的质量分数=
| 49g |
| 200g |
(2)生成氢气的质量为1g;
(3)如果把溶液蒸干,能得到固体是硫酸锌,所以固体的质量为80.5g;
(4)所得溶液的溶质质量分数=
| 80.5g |
| 32.5g+200g-1g |
答:(1)这种硫酸溶液溶质的质量是24.5%;
(2)生成氢气的质量为1g;
(3)如果把溶液蒸干,能得到80.5固体;
(4)所得溶液的溶质质量分数是34.8%.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式进行计算的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
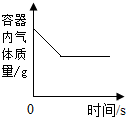
下列图象能正确反应对应变化关系的是( )
 |
 |
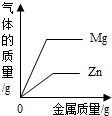 |
 |
| A.向一定量的二氧化 锰中加入过氧化氢溶液 |
B.碳在盛有氧气的 密闭容器内燃烧 |
C.向两份完全相同 的稀盐酸中分别加入锌粉、镁粉 |
D.将水通电电解一段时间 |
| A、A | B、B | C、C | D、D |
下列有关催化剂的说法正确的是( )
| A、在化学反应后其质量减少 |
| B、二氧化锰可做任何反应的催化剂 |
| C、催化剂能改变化学反应速率 |
| D、在化学反应后其化学性质发生了变化 |