题目内容
15. 如图所示,A、B、C、D是初中化学常见的物质.图中“→”表示转化关系(部分反应物和生成物已略去).其中A是大理石的主要成分,B常温下是气体,C是人体胃液中含有的酸.请回答:
如图所示,A、B、C、D是初中化学常见的物质.图中“→”表示转化关系(部分反应物和生成物已略去).其中A是大理石的主要成分,B常温下是气体,C是人体胃液中含有的酸.请回答:(1)B的化学式为CO2;
(2)D的化学式为CaCl2;
(3)C→B的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑(合理即可),该反应属于基本反应类型中的复分解反应.
分析 根据A是大理石的主要成分,B常温下是气体,能够转化为碳酸钙,C是人体胃液中含有的酸,能够转化为B,因此C是盐酸,B是二氧化碳,A是碳酸钙;C-盐酸能够转化为D,D能够转化为碳酸钙,因此D应该是盐酸反应产生的氯化钙,带入验证完成相关的问题.
解答 解:A是大理石的主要成分,B常温下是气体,能够转化为碳酸钙,C是人体胃液中含有的酸,能够转化为B,因此C是盐酸,B是二氧化碳,A是碳酸钙;C-盐酸能够转化为D,D能够转化为碳酸钙,因此D应该是盐酸反应产生的氯化钙,带入验证符合转化关系,因此:
(1)B是二氧化碳,故填:CO2;
(2)D是氯化钙,故填:CaCl2;
(3)C→B可以是盐酸和碳酸钙等反应产生的二氧化碳,该反应是两种化合物相互交换成分得到的两种新的化合物,属于复分解反应;故填:CaCO3+2HCl═CaCl2+H2O+CO2↑(合理即可);复分解.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后代入转化关系中进行验证即可.

练习册系列答案
相关题目
5.下列物质的名称、俗名与化学式完全对应的是( )
| A. | 氯化钠 食盐 NaCl2 | B. | 碳酸氢钠 纯碱 NaHCO3 | ||
| C. | 氢氧化钙 熟石灰 CaO | D. | 氢氧化钠 烧碱 NaOH |
6.以科学原理和实验事实为依据进行推理是学习化学的一种重要方法.下列推理得出的相关结论正确的是( )
| A. | 溶液是均一稳定的分散体系,所以均一稳定的分散体系一定是溶液 | |
| B. | 氢气与氧气混合点燃可能发生爆炸,所以点燃氢气前一定要检验氢气的纯度 | |
| C. | 盐酸与块状石灰石反应能制取CO2,所以稀硫酸也能与块状石灰石反应制取CO2 | |
| D. | 某物质在空气中燃烧生成CO2和H2O,所以该物质由C、H、O三种元素组成 |
10.化学与生活密切相关,下列说法不正确的是( )
| A. | 大量使用农药、化肥,提高农作物产量 | |
| B. | 回收利用废旧金属,有利于保护环境,充分利用资源 | |
| C. | 限制使用塑料袋,减少“白色污染” | |
| D. | 推广利用太阳能、风能,缓解“温室效应” |
20.我们生活国所食用的盐是加碘食盐,根据如图提供的有关信息,下列说法错误的是( )


| A. | 碘的相对原子质量是126.9 | B. | 碘的元素符号是I | ||
| C. | 碘属于金属元素 | D. | 碘的原子序数是53 |
7.为了测定一份铁镁混合粉末中铁的质量分数,某校化学兴趣小组取该样品8g分四次加入盛有100g未知浓度的硫酸溶液的烧杯(已知烧杯质量为50g)中,充分反应后,测得烧杯和烧杯内物质的质量数据记录如下:
(1)表中第三次加入混合粉末后,烧杯和烧杯内溶液的总质量是115.7g;
(2)所用硫酸溶液的溶质质量分数是14.7%;
(3)混合粉末中铁的质量分数是70%.
| 次数 | 1 | 2 | 3 | 4 |
| 加入样品的质量/g | 2 | 2 | 2 | 2 |
| 烧杯和烧杯内物质的总质量/g | 151.9 | 153.8 | 157.7 |
(2)所用硫酸溶液的溶质质量分数是14.7%;
(3)混合粉末中铁的质量分数是70%.
4.一辆客车夜晚行驶在公路上,发现油箱漏油,车厢里充满了汽油的气味,这时应该采取的应急措施是( )
| A. | 洒水降温并溶解汽油蒸气 | |
| B. | 打开所有车窗,严禁一切烟火,疏散乘客离开车厢 | |
| C. | 开灯查找漏油部位,及时修理 | |
| D. | 让车内乘客坐好,不要随意走动 |
5.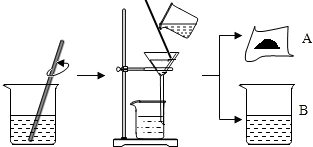 据有关资料介绍:将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某科学课外小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示.请你与小组同学共同完成以下探究:
据有关资料介绍:将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某科学课外小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示.请你与小组同学共同完成以下探究:
【提出问题1】固体A中的成分是什么?
【猜想与假设】甲同学:只有CaCO3;乙同学:CaCO3、Ca(OH)2
【实验与探究】甲、乙同学为了验证各自的猜想,分别进行了实验:
【反思与评价】小组同学讨论后认为,甲同学的实验不能证明他的猜想,理由是加入稀盐酸有气泡只能证明有碳酸钙,不能证明有无氢氧化钙;而乙同学的实验能证明他的猜想,因此小组同学确定了固体A的成分.
【提出问题2】溶液B中溶质的成分是什么?加入稀盐酸有气泡只能证明有碳酸钙,不能证明有无氢氧化钙
【猜想与假设】丙同学:KOH、K2CO3 丁同学:KOH、Ca(OH)2
【表达与交流】结合对固体成分的探究,同学们经过讨论确定了丁同学猜想正确,理由固体中含有氢氧化钙,说明溶液中的碳酸钾已完全反应.为了得到纯净的氢氧化钾,需要向溶液B中滴加适量的一种溶液,发生反应的化学方程式为K2CO3+Ca(OH)2═CaCO3↓+2KOH,小组同学通过相应的实验操作最终制得了氢氧化钾.
 据有关资料介绍:将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某科学课外小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示.请你与小组同学共同完成以下探究:
据有关资料介绍:将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某科学课外小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示.请你与小组同学共同完成以下探究:【提出问题1】固体A中的成分是什么?
【猜想与假设】甲同学:只有CaCO3;乙同学:CaCO3、Ca(OH)2
【实验与探究】甲、乙同学为了验证各自的猜想,分别进行了实验:
| 实验内容 | 实验现象 | 实验结论 |
| 甲同学:取少量固体于试管中,向其中加入稀盐酸. | 有气泡产生 | 自己的猜 想正确 |
| 乙同学:取少量固体于试管中,加水充分溶解、过滤,向滤液中滴加酚酞试液. | 溶液由无色 变为红色 | 自己的猜 想正确 |
【提出问题2】溶液B中溶质的成分是什么?加入稀盐酸有气泡只能证明有碳酸钙,不能证明有无氢氧化钙
【猜想与假设】丙同学:KOH、K2CO3 丁同学:KOH、Ca(OH)2
【表达与交流】结合对固体成分的探究,同学们经过讨论确定了丁同学猜想正确,理由固体中含有氢氧化钙,说明溶液中的碳酸钾已完全反应.为了得到纯净的氢氧化钾,需要向溶液B中滴加适量的一种溶液,发生反应的化学方程式为K2CO3+Ca(OH)2═CaCO3↓+2KOH,小组同学通过相应的实验操作最终制得了氢氧化钾.
 科学就在我们身边.
科学就在我们身边.