题目内容
14.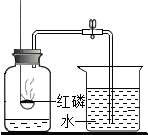 如图是测定空气中氧气含量的实验装置,请根据实验回答问题:
如图是测定空气中氧气含量的实验装置,请根据实验回答问题:(1)先用弹簧夹夹住乳胶管,将燃着的红磷立即伸入盛有少量水的集气瓶中,并把塞子塞紧,可观察到的实验现象是什么?红磷燃烧,产生大量白烟,放出大量的热待红磷熄灭,打开弹簧夹又可观察到什么现象?烧杯中的水进入集气瓶,集气瓶内水面上升,约占集气瓶中空气体积的五分之一写出反应的符号表达式4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5
(2)燃烧结束后,集气瓶内剩余的气体主要是氮气.由本实验可推知氮气的物理性质和化学性质是什么?物理性质:无色、不易溶于水化学性质:氮气不与红磷反应(或不支持燃烧)
(3)实验完毕,若进入集气瓶中水的体积不到总容积的$\frac{1}{5}$,你认为导致这一结果的原因可能是红磷的量不足、装置漏气.
分析 (1)根据红磷燃烧的现象分析解答;根据红磷燃烧的反应物及生成物写出化学方程式;根据压强的知识分析实验现象;根据实验现象分析得出结论;
(2)燃烧结束后,推知氮气的性质时,从其颜色,溶解性,是否有可燃性角度考虑.
(3)根据测定空气中氧气含量的实验的现象、结论及注意的事项分析.
解答 解:(1)红磷燃烧的现象是红磷燃烧,产生大量白烟,放出大量的热;红磷燃烧的化学方程式为4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5;红磷燃烧消耗氧气,瓶内压强减小,水倒流,倒流进水的体积即为消耗的氧气的体积,因此可知氧气约占空气总体积的五分之一;
(2)由本实验可推知氮气具有的物理性质是 无色、不易溶于水,化学性质 氮气不与红磷反应(或不支持燃烧).
(3)实验完毕,若进入集气瓶中水的体积不到总容积的$\frac{1}{5}$,你认为导致这一结果的原因可能是:红磷的量不足,装置漏气等.
答案:
(1)红磷燃烧,产生大量白烟,放出大量的热; 烧杯中的水进入集气瓶,集气瓶内水面上升,约占集气瓶中空气体积的五分之一:4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5;(2)无色、不易溶于水,氮气不与红磷反应(或不支持燃烧).
(3)红磷的量不足;装置漏气.
点评 本题主要考查用红磷测定空气组成的实验原理、操作、现象、结论和注意事项,属于常规性实验考查题,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.下列物质中属于具有还原性气体态单质的是( )
| A. | 氧气 | B. | 一氧化碳 | C. | 碳 | D. | 氢气 |
6.在100升空气里,氮气的体积大约是( )
| A. | 78升 | B. | 78% | C. | 21升 | D. | 21% |
3.某兴趣小组的同学发现,上个月做实验用的氢氧化钠溶液忘记了塞上瓶塞.这瓶溶液有没有变质呢?同学们想一探究竟,请你和他们一起参与.
【查阅资料】氯化钙溶液显中性.
【提出猜想】
假设一:该溶液没有变质;假设二:该溶液部分变质;假设三:该溶液全部变质.
【实验验证】
【讨论交流】
(1)步骤①滴加过量的氯化钙溶液的目的是除尽溶液中的碳酸钠,避免对检验氢氧化钠造成干扰;
(2)有同学提出用氢氧化钙溶液代替氯化钙溶液做同样的实验,也能看到相同的现象,得出相同的结论.你同意他的观点吗?为什么?不同意,因为加入氢氧化钡溶液引入了OH-,对检验氢氧化钠会造成干扰.
【反思】氢氧化钠敞口放置变质的原因是2NaOH+CO2═Na2CO3+H2O(用化学方程式表示),因此氢氧化钠应密封保存.
【查阅资料】氯化钙溶液显中性.
【提出猜想】
假设一:该溶液没有变质;假设二:该溶液部分变质;假设三:该溶液全部变质.
【实验验证】
| 实验步骤 | 实验现象 | 实验结论 |
| ①少量该溶液于试管中,向其中滴加过量的氯化钙溶液; | 生成白色沉淀 | 假设一不成立 |
| ②静置,向上层清液中滴加酚酞溶液. | 溶液变红 | 假设二成立 |
(1)步骤①滴加过量的氯化钙溶液的目的是除尽溶液中的碳酸钠,避免对检验氢氧化钠造成干扰;
(2)有同学提出用氢氧化钙溶液代替氯化钙溶液做同样的实验,也能看到相同的现象,得出相同的结论.你同意他的观点吗?为什么?不同意,因为加入氢氧化钡溶液引入了OH-,对检验氢氧化钠会造成干扰.
【反思】氢氧化钠敞口放置变质的原因是2NaOH+CO2═Na2CO3+H2O(用化学方程式表示),因此氢氧化钠应密封保存.
4.下列是不是单质的是( )
| A. | 水银 | B. | 水 | C. | 液氧 | D. | 硫 |
 如图是小明眼镜的照片.
如图是小明眼镜的照片. 同学们正在化学实验室完成“实验活动6--酸、碱的化学性质”
同学们正在化学实验室完成“实验活动6--酸、碱的化学性质”