题目内容
2.某二氧化锰样品中含有杂质炭,为测定该样品中二氧化锰的质量分数,某兴趣小组设计了如下实验方案:在一定量的样品中通入干燥纯净的氧气,使杂质炭在加热条件下反应生成CO2来进行分析测定.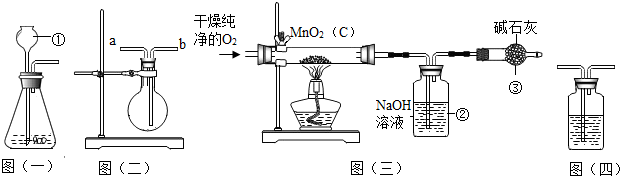
(1)仪器①的名称是长颈漏斗.如果该实验选择图(一)装置来制取氧气,则所反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)用图(二)装置可用于干燥氧气,应在烧瓶中装入浓硫酸(填试剂名称)进行干燥气体,气体应从b(“a”或“b”)端通入.
(3)图(三)是用干燥纯净的O2与样品反应来测定二氧化锰质量分数的装置,装置③中装有 碱石灰,其作用是防止空气中的二氧化碳进入②中,影响测定结果.
(4)为验证图(三)中装置②已将CO2吸收完全,可在装置②与③之间加入图(四)装置进行证明,则图(四)装置中加入的试剂为B(填字母).
A.NaOH溶液 B.澄清石灰水 C.浓硫酸.
分析 (1)根据发生装置的选择条件即可.
(2)干燥就意味着是浓硫酸,因为浓硫酸具有吸水性.
(3)由题目信息(使杂质炭在加热条件下反应生成CO2来进行分析测定)可知,二氧化碳的测定对实验很重要.因为空气也有二氧化碳.所以要消除空气中二氧化碳对实验的影响.
(4)检验二氧化碳常用试剂就是澄清石灰水.
解答 解:(1)仪器①为长颈漏斗;图一装置属于固体和液体不加热制取气体,故答案为:长颈漏斗;2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(2)干燥是一个关键词,说明需要填写一种吸水性物质,浓硫酸具有吸水性;故答案为:浓硫酸;b;
(3)根据题目信息(在一定量的样品中通入干燥纯净的氧气,使杂质炭在加热条件下反应生成CO2来进行分析测定)可知,本实验是通过计算二氧化碳的质量测定质量分数的,所以必须排除空气中的二氧化碳的干扰;二氧化碳可以和碱石灰反应;故答案为:防止空气中的二氧化碳进入②中,影响测定结果;
(4)检验二氧化碳常用方法就是通入澄清石灰水,若石灰水变浑浊,说明是二氧化碳.故答案为:B.
点评 本题考查了混合物中某成分含量的测定,完成此题,可以依据物质的性质结合题干提供的信息进行分析探究过程中各装置的作用,理清探究思路,根据探究思路逐步进行分析.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
10.现有Fe、稀H2SO4、Na2CO3溶液、Ca(OH)2溶液、Fe2O3两两混合后,能发生反应的有( )
| A. | 7个 | B. | 6个 | C. | 5个 | D. | 4个 |
13. 我国古代纺织业常将草木灰(主要成分K2CO3)和生石灰在水中混合,用上层清液漂白织物.
我国古代纺织业常将草木灰(主要成分K2CO3)和生石灰在水中混合,用上层清液漂白织物.
【资料】①K2CO3+Ca(OH)2=CaCO3↓+2KOH
②Ca(OH)2、K2CO3和KOH的部分溶解度如下表:
(1)20℃时,100g水中最多可溶解K2CO3的质量是110g,溶质的质量分数为50%的KOH溶液属于不饱和溶液(填“饱和”或“不饱和”).
(2)某温度时,向一定量的饱和氢氧化钙溶液中加入少量生石灰,恢复到原温度,某些量随时间变化的关系如图所示.则纵坐标可能表示的是ac(填序号).
a.溶质的质量 b.溶剂的质量
c.溶液的质量 d.溶质的质量分数
e.氢氧化钙的溶解度
(3)20℃时,将1.38g K2CO3固体放入100g水中,并加入一定量的氢氧化钙,搅拌使其充分反应,恢复到原温度,过滤,得到质量为1.1g的固体.所得滤液中的溶质是氢氧化钾和氢氧化钙,加入氢氧化钙的质量是1g.
 我国古代纺织业常将草木灰(主要成分K2CO3)和生石灰在水中混合,用上层清液漂白织物.
我国古代纺织业常将草木灰(主要成分K2CO3)和生石灰在水中混合,用上层清液漂白织物.【资料】①K2CO3+Ca(OH)2=CaCO3↓+2KOH
②Ca(OH)2、K2CO3和KOH的部分溶解度如下表:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | |
| 溶解度/g | Ca(OH)2 | 0.18 | 0.17 | 0.16 | 0.15 | 0.14 |
| K2CO3 | 107 | 109 | 110 | 114 | 121 | |
| KOH | 97 | 103 | 112 | 126 | 140 | |
(2)某温度时,向一定量的饱和氢氧化钙溶液中加入少量生石灰,恢复到原温度,某些量随时间变化的关系如图所示.则纵坐标可能表示的是ac(填序号).
a.溶质的质量 b.溶剂的质量
c.溶液的质量 d.溶质的质量分数
e.氢氧化钙的溶解度
(3)20℃时,将1.38g K2CO3固体放入100g水中,并加入一定量的氢氧化钙,搅拌使其充分反应,恢复到原温度,过滤,得到质量为1.1g的固体.所得滤液中的溶质是氢氧化钾和氢氧化钙,加入氢氧化钙的质量是1g.
10.下列溶液久置于空气中,溶质成分不变,但溶质的质量分数减小且溶液质量增加( )
| A. | 浓硫酸 | B. | 浓盐酸 | C. | 食盐溶液 | D. | 石灰水 |
11.镁在空气中燃烧时,发生如下两个反应:2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO,3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2.则24g镁在空气中燃烧可得产物的质量为( )
| A. | 等于33.3 g | B. | 等于40 g | C. | 33.3~40 g | D. | 小于33.3 g |
 小琪往如图所示的烧杯中加入一种物质,轻轻搅拌后,粘在烧杯上的塑料片脱落.加入的物质可能是C
小琪往如图所示的烧杯中加入一种物质,轻轻搅拌后,粘在烧杯上的塑料片脱落.加入的物质可能是C