题目内容
11.镁在空气中燃烧时,发生如下两个反应:2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO,3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2.则24g镁在空气中燃烧可得产物的质量为( )| A. | 等于33.3 g | B. | 等于40 g | C. | 33.3~40 g | D. | 小于33.3 g |
分析 采用极值法考虑,计算假设全部生成氮化镁的质量,假设全部生成氧化镁的质量,结果会介于二者之间.
解答 解:设24g镁与氮气反应生成氮化镁质量为X,生成氧化镁质量为Y
3Mg+N2=Mg3N2,2Mg+O2=2MgO
72 100 48 80
24g X 24g Y
根据:$\frac{72}{24g}=\frac{100}{X}$
解得X=33.3g
根据:$\frac{48}{24g}=\frac{80}{Y}$
解得Y=40g,由于镁不可能只生成一种物质,所以产物质量要介于二者之间.
故选C.
点评 要学会运用极值法进行计算,要知道镁在空气中燃烧时产物一定不能是一种.

练习册系列答案
相关题目
19.从100g 15%的NaCl溶液中取出10g,那么剩下的90g NaCl溶液的质量百分比浓度是( )
| A. | 1% | B. | 9% | C. | 15% | D. | 11.1% |
6.我们日常食用的蔗糖,如果置于密闭的容器中加热会生成炭黑和水.这说明( )
| A. | 蔗糖是由炭黑和水组成的 | B. | 蔗糖是由C、H、O元素组成的纯净物 | ||
| C. | 蔗糖是由C、H、O元素组成的混合物 | D. | 蔗糖中含有炭黑和水 |
16.下列各组物质中,前者是单质后者是化合物的是( )
| A. | 氧气、氢气 | B. | 液态氧、食用碱 | C. | 自来水、蒸馏水 | D. | 二氧化碳、铁 |
20.下列“家庭小实验”不能达到预期目的是( )
| A. | 用柠檬酸、果汁、白糖、水、小苏打等制取汽水 | |
| B. | 用自制简易净水器来制取纯净水 | |
| C. | 用空塑料瓶、小卵石、石英沙、活性炭、膨松棉等制作简易净水器 | |
| D. | 用酒精浸泡捣烂的某些植物的花瓣可制酸碱指示剂 |
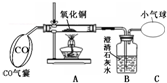 如图为一氧化碳与氧化铜反应的实验装置.请回答:
如图为一氧化碳与氧化铜反应的实验装置.请回答: