题目内容
6.下列物质放入水中,充分振荡后不能形成溶液的是( )| A. | 氯化银 | B. | 酒精 | C. | 蔗糖 | D. | 硝酸钾 |
分析 一种或几种物质分散到另一种物质中,形成均一的、稳定的混合物叫做溶液,它的基本特征是均一性和稳定性;只有被分散的物质在水中是可溶的,二者混合后才会形成溶液.
解答 解:A、氯化银不溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液,故选项正确.
B、酒精易溶于水,形成均一、稳定的混合物,属于溶液,故选项错误.
C、蔗糖易溶于水,形成均一、稳定的混合物,属于溶液,故选项错误.
D、硝酸钾易溶于水,形成均一、稳定的混合物,属于溶液,故选项错误.
故选:A.
点评 本题难度不大,掌握溶液的本质特征、各种物质的水溶性方面的知识是解答本题的关键.

练习册系列答案
相关题目
17.饮料中的果味大多来自酯类,丁酸乙酯( C6H12O2) 是无色具有菠萝香味的液体,常用作食品、饮料的调香剂.下列叙述正确的是( )
| A. | 丁酸乙酯是由20个原子构成的 | |
| B. | 丁酸乙酯的相对分子质量为116 g | |
| C. | 丁酸乙酯中碳、氢、氧元素的质量比为18:3:8 | |
| D. | 丁酸乙酯中氢元素的质量分数最大 |
14.废铁屑的主要成份是铁,同时还有少量铁锈(Fe 2O 3),动物饲料硫酸亚铁的生产工艺之一如下图所示:
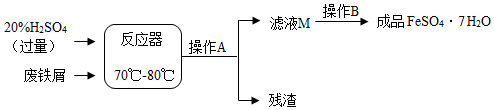
(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外还有:Fe+H2SO4=FeSO4+H2↑,Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(2)滤液M中肯定含有的溶质的化学式是FeSO4、H2SO4、;
(3)在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和漏斗;
(4)滤液M经过操作B可得硫酸亚铁晶体(FeSO47H2O).已知硫酸亚铁的溶解度和析出晶体的组成如下表:
根据溶解度表,硫酸亚铁晶体(FeSO47H2O)冷却结晶温度最高不超过64℃;
(5)在化学反应中,若有元素化合价变化的反应定义为氧化还原反应.下列反应类型肯定是氧化还原反应的是B(填字母编号).
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
硫酸亚铁晶体加强热会发生反应2FeSO4•7H2O $\frac{\underline{\;高温\;}}{\;}$Fe 2O 3+SO2+X+7H2O 其生成物X的化学式SO3,该反应是(填“是”或“不是”)氧化还原反应.

(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外还有:Fe+H2SO4=FeSO4+H2↑,Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(2)滤液M中肯定含有的溶质的化学式是FeSO4、H2SO4、;
(3)在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和漏斗;
(4)滤液M经过操作B可得硫酸亚铁晶体(FeSO47H2O).已知硫酸亚铁的溶解度和析出晶体的组成如下表:
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 | ||
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||
(5)在化学反应中,若有元素化合价变化的反应定义为氧化还原反应.下列反应类型肯定是氧化还原反应的是B(填字母编号).
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
硫酸亚铁晶体加强热会发生反应2FeSO4•7H2O $\frac{\underline{\;高温\;}}{\;}$Fe 2O 3+SO2+X+7H2O 其生成物X的化学式SO3,该反应是(填“是”或“不是”)氧化还原反应.
1.下列关于钠原子和钠离子的说法中,正确的是( )
| A. | 它们的电子层数不同 | B. | 它们的化学性质相似 | ||
| C. | 钠原子的质量比钠离子大得多 | D. | 它们的最外层电子数相同 |
18.经常食用海带、紫菜可以预防甲状腺疾病是因为它们富含的元素是( )
| A. | Cl | B. | Zn | C. | Fe | D. | I |
15.下列有关元素的说法中正确的是( )
| A. | 元素是具有相同质子数的粒子的总称 | |
| B. | 元素的原子序数与该元素原子的核电荷数相同 | |
| C. | 由同种元素组成的物质一定是单质 | |
| D. | 在物质发生化学变化时,元素种类可能会变 |
16.下列实验操作正确的是( )
| A. |  过滤 | B. |  点燃酒精灯 | C. |  闻气味 | D. |  倾倒液体 |
 (1)请从H、C、O、Ca、Fe五种元素中选一种或几种元素,写出符合下列要求的化学式或名称.
(1)请从H、C、O、Ca、Fe五种元素中选一种或几种元素,写出符合下列要求的化学式或名称.