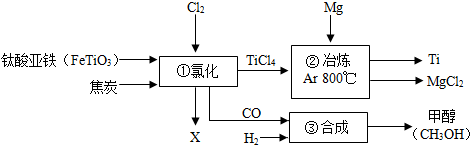
题目内容
 如图1是几种固体的溶解度曲线.
如图1是几种固体的溶解度曲线.(1)10℃时,这几种固体中
(2)向烧杯中加入100g水,将含160g硝酸钾和10g氯化钠的混合物加入该烧杯中,溶解配成80℃的溶液,再冷却到10℃,烧杯中析出的固体的名称是
(3)在40℃时,将溶质质量分数相等的KNO3和NaCl溶液,冷却到20℃,此时关于它们溶质质量分数的下
列说法错误的是
A.可能KNO3溶液的溶质质量分数大 B.可能NaCl溶液的溶质质量分数大 C.两者可能仍旧相等
(4)图2是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:
用图2表示的序号表示配制溶液的正确操作顺序

考点:固体溶解度曲线及其作用,一定溶质质量分数的溶液的配制,结晶的原理、方法及其应用
专题:溶液、浊液与溶解度
分析:(1)根据溶解度曲线来分析;
(2)根据物质的溶解度和溶解度受温度的影响情况来分析解答;
(3)据二者的溶解度随温度变化情况及溶液中溶质的质量分数计算方法分析解答;
(4)根据配制溶液的步骤和改变溶液浓度的方法来考虑本题.
(2)根据物质的溶解度和溶解度受温度的影响情况来分析解答;
(3)据二者的溶解度随温度变化情况及溶液中溶质的质量分数计算方法分析解答;
(4)根据配制溶液的步骤和改变溶液浓度的方法来考虑本题.
解答:解:(1)由溶解度曲线可知,在10℃时,硝酸钾的溶解度最小;
(2)根据溶解度曲线可知,在在10℃时,硝酸钾的溶解度为20g,氯化钠的溶解度为大于30g,则硝酸钾结晶析出,析出晶体的质量为:160g-20g=140g;硝酸钾的溶解度受温度影响比较大,氯化钠的溶解度受温度影响不太大,故可采取降温结晶的方法来进行提纯;
(3)KNO3的溶解度随温度的降低而降低,NaCl的溶解度随温度变化不大;在40℃时,将质量分数相等的KNO3和NaCl溶液,冷却到20℃,由于降温前溶液不知是否饱和,故降温到20℃时可能二者仍不饱和,则溶质的质量分数不变,也可能二者都达到饱和,据饱和溶液中质量分数的计算式
×100%可知:溶解度大则溶质质量分数大,20℃时氯化钠的溶解度大于硝酸钾的溶解度,所以氯化钠的溶质质量分数大于硝酸钾的溶质质量分数,不可能是A这种情况;
(4)配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放,要注意在称量前先取出药品才能称量;图中还缺少药匙和胶头滴管;
设需要加入氯化钠的质量为x,则
×100%=20%
x=12.5g.
故答案为:(1)硝酸钾;
(2)硝酸钾;140;降温;
(3)A;
(4)③②④⑤①; 药匙和胶头滴管;12.5.
(2)根据溶解度曲线可知,在在10℃时,硝酸钾的溶解度为20g,氯化钠的溶解度为大于30g,则硝酸钾结晶析出,析出晶体的质量为:160g-20g=140g;硝酸钾的溶解度受温度影响比较大,氯化钠的溶解度受温度影响不太大,故可采取降温结晶的方法来进行提纯;
(3)KNO3的溶解度随温度的降低而降低,NaCl的溶解度随温度变化不大;在40℃时,将质量分数相等的KNO3和NaCl溶液,冷却到20℃,由于降温前溶液不知是否饱和,故降温到20℃时可能二者仍不饱和,则溶质的质量分数不变,也可能二者都达到饱和,据饱和溶液中质量分数的计算式
| 溶解度 |
| 溶解度+100g |
(4)配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放,要注意在称量前先取出药品才能称量;图中还缺少药匙和胶头滴管;
设需要加入氯化钠的质量为x,则
| 100g×10%+x |
| 100g+x |
x=12.5g.
故答案为:(1)硝酸钾;
(2)硝酸钾;140;降温;
(3)A;
(4)③②④⑤①; 药匙和胶头滴管;12.5.
点评:本题主要考查了学生对溶解度曲线的认识、饱和溶液和不饱和溶液的相互转化、溶质的质量分数等知识,能较好考查学生分析、解决问题的能力.

练习册系列答案
相关题目
在下列过程中没有发生化学变化的是( )
| A、食物腐败 | B、钢铁生锈 |
| C、酒精挥发 | D、碳酸铵分解 |
下列试验操作中,不正确的是( )
A、 液体取用 |
B、 读取液体体积 |
C、 给液体加热 |
D、 检查气密性 |
 ,x=
,x=