题目内容
小红同学在自己家乡看到一些石灰石,他想探究石灰石中碳酸钙的含量,于是他取部分石灰石带到实验室,砸碎后称取10g于烧杯中,加入足量然后往烧杯中加入足量的稀盐酸90g,充分反应后,称得反应剩余物为97.8g.(假设其他物质不与盐酸反应)请计算:
(1)产生二氧化碳气体的质量是多少g?
(2)计算石灰石中碳酸钙的质量分数是多少?
(1)产生二氧化碳气体的质量是多少g?
(2)计算石灰石中碳酸钙的质量分数是多少?
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:(1)反应后剩余物的总质量比反应前的减少,根据质量守恒定律知,减少的质量就是生成二氧化碳的质量.
(2)由二氧化碳的质量根据碳酸钙与盐酸反应的化学方程式可以计算出大理石中碳酸钙的质量分数.
(2)由二氧化碳的质量根据碳酸钙与盐酸反应的化学方程式可以计算出大理石中碳酸钙的质量分数.
解答:解:(1)产生二氧化碳的质量为
10g+90g-97.8g=2.2g.
(2)设该大理石中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 2.2g
=
解之得:x=5g
所以大理石中碳酸钙的质量分数:
×100%=50%
答:(1)生成二氧化碳的质量为2.2克,
(2)该大理石中碳酸钙的质量分数为50%.
10g+90g-97.8g=2.2g.
(2)设该大理石中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 2.2g
| 100 |
| x |
| 44 |
| 2.2g |
解之得:x=5g
所以大理石中碳酸钙的质量分数:
| 5g |
| 10g |
答:(1)生成二氧化碳的质量为2.2克,
(2)该大理石中碳酸钙的质量分数为50%.
点评:本题主要考查质量守恒定律和含杂质物质的化学方程式计算,难度适中.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组物质中,按氧化物、酸、碱、盐顺序排列的是( )
| A、CO KNO3 NaOH HCl |
| B、SO2 Ca(OH)2 HCl NaCl |
| C、Fe2O3 H2SO4 Na2CO3 Ba (OH)2 |
| D、MgO HNO3 KOH CuSO4 |
盛装白磷的试剂瓶上应张贴的标志是( )
A、 |
B、 |
C、 |
D、 |

 如图1是几种固体的溶解度曲线.
如图1是几种固体的溶解度曲线.
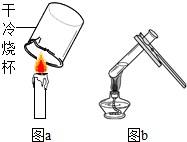 (1)某同学用图a所示的方法检验蜡烛的燃烧产物,将烧杯放在蜡烛火焰上方十几秒钟,发现烧杯壁上没有水雾出现,原因可能是
(1)某同学用图a所示的方法检验蜡烛的燃烧产物,将烧杯放在蜡烛火焰上方十几秒钟,发现烧杯壁上没有水雾出现,原因可能是