题目内容
某化工企业生产流程示意图如图:
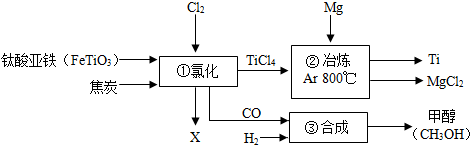
(1)钛酸亚铁中Ti元素的化合价为 价.
(2)反应①中化学方程式为:2FeTiO3+6C+7Cl2
2X+2TiCl4+6CO,则X的化学式为 .(3)反应②中的氩气(Ar)作保护气,请写出此反应的化学方程式 .该反应的基本类型是 反应.金属钛和金属镁相比较, 金属活动性较强.
(4)反应③中要使原料全部转化为甲醇,理论上CO和H2投料的质量比为 .

(1)钛酸亚铁中Ti元素的化合价为
(2)反应①中化学方程式为:2FeTiO3+6C+7Cl2
| ||
(4)反应③中要使原料全部转化为甲醇,理论上CO和H2投料的质量比为
考点:物质的相互转化和制备,金属的化学性质,有关元素化合价的计算,反应类型的判定,质量守恒定律及其应用,书写化学方程式、文字表达式、电离方程式
专题:物质的制备
分析:(1)根据在化合物中正负化合价代数和为零考虑;
(2)根据质量守恒定律推断x的化学式;
(3)根据化学方程式的书写方法填写化学方程式;
(4)根据氢气和一氧化碳反应的方程式考虑质量比.
(2)根据质量守恒定律推断x的化学式;
(3)根据化学方程式的书写方法填写化学方程式;
(4)根据氢气和一氧化碳反应的方程式考虑质量比.
解答:解:(1)设FeTiO3中P的化合价是x.FeTiO3中Fe的化合价是+2价,O的化合价是-2价,利用化合物中各元素的化合价的代数和为零的原则得到方程(+2)+x+(-2)×3=0
解得,x=+4 所以钛酸亚铁(FeTiO3)中钛元素的化合价是+4价;
(2)根据质量守恒定律,在反应前后各元素原子的个数不变.从2FeTiO3+6C+7Cl2=2X+2TiCl4+6CO看钛原子、氧原子、碳原子反应前后除物质x外个数已经相等,故x中无钛原子、氧原子、碳原子.铁反应前共有2个,反应后只有x有,所以2x中有2个,从而x中有1个;氯原子反应前有14个,反应后x除外有8个,所以2x中有6个,因此x中有3个,因此x的化学式是FeCl3;
(3)TiCl4与Mg反应的反应物是TiCl4与Mg,生成物是Ti和MgCl2,用观察法配平即可,因此该反应的化学方程式是TiCl4+2Mg
Ti+2MgCl2;据此反应为一种单质与一种化合物反应,生成另一种单质和另一种化合物,故此反应为置换反应;据置换反应的性质知,金属钛和金属镁相比较,镁的金属活动性较强.
(4)根据从化学方程式2H2+CO═CH3OH
4 28
由此可知一氧化碳和氢气的质量比是:28:4=7:1.
故答案为:
(1)+4;
(2)FeCl3;
(3)TiCl4+2Mg
Ti+2MgCl2,置换,镁;
(4)7:1.
解得,x=+4 所以钛酸亚铁(FeTiO3)中钛元素的化合价是+4价;
(2)根据质量守恒定律,在反应前后各元素原子的个数不变.从2FeTiO3+6C+7Cl2=2X+2TiCl4+6CO看钛原子、氧原子、碳原子反应前后除物质x外个数已经相等,故x中无钛原子、氧原子、碳原子.铁反应前共有2个,反应后只有x有,所以2x中有2个,从而x中有1个;氯原子反应前有14个,反应后x除外有8个,所以2x中有6个,因此x中有3个,因此x的化学式是FeCl3;
(3)TiCl4与Mg反应的反应物是TiCl4与Mg,生成物是Ti和MgCl2,用观察法配平即可,因此该反应的化学方程式是TiCl4+2Mg
| ||
| Ar |
(4)根据从化学方程式2H2+CO═CH3OH
4 28
由此可知一氧化碳和氢气的质量比是:28:4=7:1.
故答案为:
(1)+4;
(2)FeCl3;
(3)TiCl4+2Mg
| ||
| Ar |
(4)7:1.
点评:本题主要考查了化合价的计算、化学方程式的书写以及质量守恒定律的应用,同时考查了学生从题目中获取信息并运用的能力.计算元素的化合价时一定要注意,一定不要忘记填上正号.

练习册系列答案
相关题目
掌握化学知识能帮助人们提高自我保护意识,下列做法不会危害人体健康的是( )
| A、在面食中添加工业甲醛 |
| B、霉变的大米淘净后食用 |
| C、用含碳酸氢钠的发酵粉焙制糕点 |
| D、为防止缺钙,大量服用含钙的保健药剂 |
下列实验现象不能说明装置气密性良好的是( )
A、 |
B、 |
C、 |
D、 |
 如图是A.B两种固体物质的溶解度曲线.
如图是A.B两种固体物质的溶解度曲线.
 如图是医用输液观察滴夜快慢的滴壶,若把它作为微型洗气装置,则气体应从
如图是医用输液观察滴夜快慢的滴壶,若把它作为微型洗气装置,则气体应从 如图1是几种固体的溶解度曲线.
如图1是几种固体的溶解度曲线.
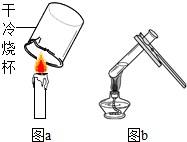 (1)某同学用图a所示的方法检验蜡烛的燃烧产物,将烧杯放在蜡烛火焰上方十几秒钟,发现烧杯壁上没有水雾出现,原因可能是
(1)某同学用图a所示的方法检验蜡烛的燃烧产物,将烧杯放在蜡烛火焰上方十几秒钟,发现烧杯壁上没有水雾出现,原因可能是