题目内容
14. 将V1mL3.65% HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL,溶液密度均看成1g/mL).下列叙述正确的是( )
将V1mL3.65% HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL,溶液密度均看成1g/mL).下列叙述正确的是( )| A. | 做该实验时环境温度为22℃ | |
| B. | 该实验表明溶液的pH先升高后下降 | |
| C. | NaOH溶液中溶质质量分数约为6% | |
| D. | 该实验表明有水生成的反应都是放热反应 |
分析 A、从图示观察起始温度即为实验时环境温度;
B、根据图示进行分析;
C、根据氢氧化钠溶液与盐酸溶液反应方程式进行计算;
D、根据一个反应无法得出此结论.
解答 解:
A、从图示观察起始温度即为实验时环境温度,因此该实验开始时温度是20℃,故A错误;
B、由图示可以看出酸和碱恰好完全反应,pH=7,故B错误;
C、恰好反应时参加反应的盐酸溶液的质量是30g,由m1+m2=50g可知,消耗的氢氧化钠溶液的质量为20g.
设恰好反应时氢氧化钠溶液中溶质的质量是X.
HCl+NaOH=NaCl+H 2O
36.5 40
30g×3.65% X
$\frac{36.5}{30g×3.65%}=\frac{40}{X}$
x=≈0.12g
氢氧化钠溶液溶质的质量分数=$\frac{0.12g}{20g}$×100%=6%,故C正确;
D、只是该反应放热,其他有水生成的反应不一定,故D错误.
故选C.
点评 本题结合中和反应考查了同学们观察分析问题的能力,以及利用化学方程式计算的能力,比较综合,要认真分析解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列变化中,属于化学变化的是( )
| A. |  轮胎爆裂 | B. |  油气爆炸 | C. |  墙屋倒塌 | D. |  石板切割 |
5.分析推理是化学常用的一种学习方法.下列推理正确的是( )
| A. | 熟石灰能和酸发生反应,所以可用熟石灰改良酸性土壤 | |
| B. | 碱能使酚酞试液变红色,所以使酚酞试液变红色的一定是碱 | |
| C. | 酸能使紫色石蕊试液变红色,CO2也能使紫色石蕊试液变红色,所以CO2是酸 | |
| D. | 木炭燃烧的剧烈程度由它的着火点决定,而与氧气的浓度无关 |
2.下列各组微粒中,各微粒具有相同电子数的一组是( )
| A. | Na、Mg2+、Al3+ | B. | HF、OH -、NH4+ | C. | S、Cl-、Ar | D. | CH4、NH3、H2S |
9.根据化学实验常识,判断下列事故处理方法正确的是( )
| A. | 高层住房着火时,立即打开所有门窗 | |
| B. | 家用电器着火时,立即用水浇灭 | |
| C. | 炒菜时油锅着火,立即盖上锅盖 | |
| D. | 发现煤气泄露时,立即打开排风扇电源开关 |
19.在一定条件下,木炭、一氧化碳、氢气都能与氧化铜发生反应,下列对这三个反应的分析,正确的是( )
| A. | 所发生的反应都是置换反应 | |
| B. | 反应后都能生成二氧化碳气体 | |
| C. | 反应后都能生成红色的固体 | |
| D. | 反应前后各元素的化合价都发生了变化 |
6.运载浓硫酸的卡车在公路上侧翻,装酸罐破裂,酸到处泄露.为了尽量减轻浓硫酸对周边环境的影响,下列措施不合理的是( )
| A. | 将熟石灰洒在浓硫酸上 | B. | 用生石灰掩埋浓硫酸 | ||
| C. | 将纯碱洒在浓硫酸上 | D. | 用大量的水稀释浓硫酸 |
4.氧气是空气的主要成分之一,下列有关氧气的说法错误的是( )
| A. | 通常状况下是无色无味气体 | |
| B. | 用带火星的木条可以检验氧气 | |
| C. | 鱼类能在水中生存,证明氧气易溶于水 | |
| D. | 通常状况下密度略大于空气的密度 |
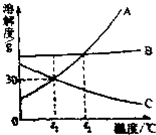 如图是A、B、C三种物质的溶解度曲线.看图回答问题:
如图是A、B、C三种物质的溶解度曲线.看图回答问题: