题目内容
16.实验室常用下列装置制取气体,请你根据所学知识回答下列问题.
(1)仪器a的名称是酒精灯.
(2)实验室制取氧气时,选用的收集装置是C(填字母序号).若改用如图I装置收集氧气、则气体应从b进(填“a”或“b”).
(3)实验室用B装置制取二氧化碳气体时,将生成的气体通入澄清石灰水中,未见变浑浊.为探究其原因,进行了如下过程:
【作出猜想】
A.石灰水已经完全变质;
B.气体中有挥发出来的HCl气体.
【实验探究】
①取少量石灰水于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到溶液变红色.于是排除了猜想A,你认为排除猜想A的理由是酚酞试液变红,说明溶液中存在碱性物质Ca(OH)2.
②小明想探究所得气体中是否有挥发出来的HCl气体,设计如下实验.请你帮他完成实验,填写以下表格:
| 实验步骤 | 实验现象 | 实验结论 |
| 气体中有HCl |
碳酸钠溶液中通入二氧化碳发生反应:Na2CO3+CO2+H2O═2NaHCO3
【拓展延伸】
如果用上述原料制得纯净的二氧化碳气体,所选仪器的连接顺序为BHEC(填字母).
分析 (1)根据实验室常用仪器回答;
(2)根据氧气的密度比空气大,不易溶于水,氧气密度比水小进行分析;
(3)根据碳酸钙和盐酸反应生成氯化钙、水和二氧化碳进行分析;
【实验探究】①根据碱能使酚酞变红色进行分析;
②根据氯离子和银离子会生成氯化银沉淀进行分析;
【拓展延伸】根据实验室制取二氧化碳的反应物是固体和液体,反应条件生成物,生成的二氧化碳中含有氯化氢气体、水蒸气,需要先用碳酸氢钠溶液将氯化氢除去,再用浓硫酸干燥,然后用向上排空气法收集二氧化碳进行分析.
解答 解:(1)通过分析题中所指仪器的作用可知,a是酒精灯;
(2)氧气的密度比空气大,不易溶于水,所以收集氧气可以用排水法和向上排空气法进行收集,选用的收集装置是C,氧气密度比水小,所以改用图Ⅰ装置收集氧气,则气体应从b进入;
(3)【实验探究】①碱能使酚酞变红色,所以排除猜想A的理由是:酚酞试液变红,说明溶液中存在碱性物质Ca(OH)2;
②氯离子和银离子会生成氯化银沉淀,氯化氢溶于水形成盐酸,所以
| 实验步骤 | 实验现象 | 实验结论 |
| 将生成的气体通入AgNO3 溶液中 | 产生白色沉淀 | 气体中有HCl |
故答案为:(1)酒精灯;
(2)C,b;
(3)【实验探究】①酚酞试液变红,说明溶液中存在碱性物质Ca(OH)2;
②
| 实验步骤 | 实验现象 | 实验结论 |
| 将生成的气体通入AgNO3 溶液中 | 产生白色沉淀 | 气体中有HCl |
点评 本题主要考查常见气体的发生装置与收集装置的探究,气体的检验、常用仪器等知识,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1. 构建分子模型是研究分子的常用方法.复方冬青油软膏具有强力迅速镇痛的作用,其有效成分的分子模型如图所示,下列说法中正确的是( )
构建分子模型是研究分子的常用方法.复方冬青油软膏具有强力迅速镇痛的作用,其有效成分的分子模型如图所示,下列说法中正确的是( )
 构建分子模型是研究分子的常用方法.复方冬青油软膏具有强力迅速镇痛的作用,其有效成分的分子模型如图所示,下列说法中正确的是( )
构建分子模型是研究分子的常用方法.复方冬青油软膏具有强力迅速镇痛的作用,其有效成分的分子模型如图所示,下列说法中正确的是( )| A. | 该有机物的化学式为C8H7O3 | |
| B. | 该有机物中碳、氢、氧的质量比为8:8:3 | |
| C. | 与分子模型相比,化学式不能表示分子中原子的排列方式,因此,分子模型比化学式更有推广价值 | |
| D. | 该有机物完全燃烧生成二氧化碳和水 |
5.火力发电厂常用煤作燃料,煤燃烧时会产生SO2和NO2气体,气体排放到大气中易形成( )
| A. | 白色污染 | B. | 温室效应 | C. | 臭氧空洞 | D. | 酸雨 |
6.元素周期表中,同周期元素的结构和性质呈现一定的规律性变化.下表列出的是第三周期元 素的原子半径及主要化合价(部分信息未列出).下列有关说法不正确的是( )
| 元素 | Na | Mg | ① | Si | P | ② | Cl |
| 原子的最外层电子数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 原子半径(10-10m) | 1.86 | 1.60 | 1.43 | ③ | 1.10 | 1.02 | 0.994 |
| 最高正价,最低负价 | +1 | +2 | ④ | +4,-4 | +5,一3 | ⑤ | +7,-1 |
| A. | ⑤处的最高正价是+6,最低负价是-2 | |
| B. | ③处的数值介于I.10-1.43之间 | |
| C. | 元素①的原子序数是13,①和②形成的化合物的化学式为AlS | |
| D. | 第三周期元素(Na-Cl)的最高正价数等于其原子的最外层电子数 |
 结合图回答下列问题.
结合图回答下列问题.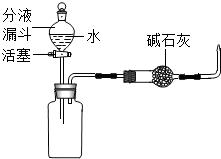 水田或池塘里常常不时地冒出一些气泡,几位同学决心弄清这种气泡的成分.请你与他们一起完成如下的探究.
水田或池塘里常常不时地冒出一些气泡,几位同学决心弄清这种气泡的成分.请你与他们一起完成如下的探究. 碳、氧、硫(C、O、S) 等元素在不同化合物(如坐标中的A-D物质)中化合价不同,其性质也不同.
碳、氧、硫(C、O、S) 等元素在不同化合物(如坐标中的A-D物质)中化合价不同,其性质也不同.