题目内容
12.某白色固体可能含有Na2CO3、CaC12、NaOH、CuSO4中的一种或几种,进行如图实验.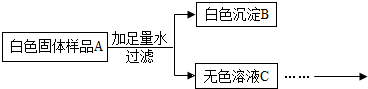
(1)原白色固体A中一定没有CuSO4;
(2)写出产生沉淀B的化学方程式CaCl2+Na2CO3═CaCO3↓+2NaCl;
(3)为验证白色固体A中含有NaOH,进一步对无色溶液C进行实验,可以加入的试剂是CD(若两种试剂依次加入足量)
A.酚钛 B.Ca(OH)2和酚酞 C.CaC12和酚酞 D.CaCl2和CuSO4.
分析 根据题干提供的物质的性质进行分析,氯化钙能与碳酸钠反应生成碳酸钙沉淀,硫酸铜的水溶液为蓝色,氢氧化钠溶液为碱性,据此分析.
解答 解:取样,加足量的水,过滤.得到白色沉淀B和无色溶液C,说明固体中不含有硫酸铜,得到的沉淀是碳酸钙,因此白色固体中一定含有碳酸钠和氯化钙,一定没有硫酸铜,可能含有氢氧化钠;因此:
(1)原白色固体A中一定没有硫酸铜;故填:CuSO4;
(2)氯化钙能与碳酸钠反应生成碳酸钙沉淀和氯化钠,故填:CaCl2+Na2CO3═CaCO3↓+2NaCl;
(3)A、酚酞试液变成红色,可能是碳酸钠的作用,不能证明氢氧化钠的存在,故错误;
B、氢氧化钙和碳酸钠反应产生氢氧化钠,不能证明氢氧化钠的存在,故错误;
C、氯化钙可以和碳酸钠,除去碳酸钠,若酚酞试液变成红色,说明溶液显碱性,可以证明氢氧化钠的存在,故正确;
D、氯化钙可以和碳酸钠,除去碳酸钠,滴加硫酸铜若产生蓝色沉淀,说明氢氧化钠的存在,故正确;
故答案为:CD.
点评 本题考查了常见混合物成分的推断,完成此题,可以依据题干提供的实验现象结合物质的性质进行.要完成此类题目,要熟练掌握常见物质的性质,以及反应时的有关现象.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
20.人呼出的气体中含量最多的是( )
| A. | 氮气 | B. | 氧气 | C. | 稀有气体 | D. | 二氧化碳 |
3.分析推理是化学学习中常用的思维方法.下列说法正确的是( )
| A. | 单质是由同种元素组成的,所以同种元素组成的物质都是单质 | |
| B. | 溶液具有均一、稳定的特征,所以均一、稳定的液体一定是溶液 | |
| C. | 化学变化都遵循质量守恒定律,所以质量不发生改变的变化就是化学变化 | |
| D. | 酸性溶液能使紫色石蕊试液变红,所以能使紫色石蕊试液变红的溶液呈酸性 |
20.如表是NaOH和Ca(OH)2的溶解度数据,请回答下列问题.
(1)从表中数据可以获得的信息是同温下氢氧化钠的溶解度远远大于氢氧化钙的溶解度(写一条).
(2)把80℃时NaOH的饱和溶液降温至20℃,可以看到的现象是溶液变浑浊;现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液的溶质质量分数乙<甲(填“>”、“<”或“=”)
(3)某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如下操作流程.请回答:
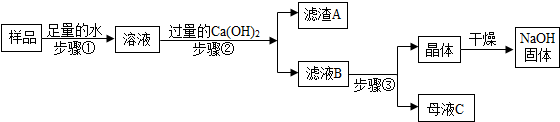
(Ⅰ)步骤②反应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;加入过量Ca(OH)2的目的是使碳酸钠完全反应.
(Ⅱ)步骤③所包含的具体操作是加热浓缩、降温结晶.
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
| NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |
(2)把80℃时NaOH的饱和溶液降温至20℃,可以看到的现象是溶液变浑浊;现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液的溶质质量分数乙<甲(填“>”、“<”或“=”)
(3)某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如下操作流程.请回答:

(Ⅰ)步骤②反应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;加入过量Ca(OH)2的目的是使碳酸钠完全反应.
(Ⅱ)步骤③所包含的具体操作是加热浓缩、降温结晶.
17.下列关于物质的认识正确的是( )
| A. | 所有溶液都能导电 | |
| B. | 不锈钢是永不生锈的钢铁 | |
| C. | 可燃性气体与空气充分接触一定发生爆炸 | |
| D. | 空气中CO2浓度过高,会对人体产生有害影响 |
1.物质的性质决定其用途,下列物质的用途与其性质对应关系错误的是( )
| A. | 氮气常用作保护气--氮气化学性质稳定 | |
| B. | 固体二氧化碳可用人工降雨--二氧化碳能与碱反应 | |
| C. | 氢氧化钙可用来改良酸性土壤--氢氧化钙溶液呈碱性 | |
| D. | 氧化钙可做食品干燥剂--氧化钙能与水反应 |

 如图是常见干电池的剖面图,据此回答下列问题.
如图是常见干电池的剖面图,据此回答下列问题.