题目内容
20.下列叙述中不正确的是( )| A. | 钠原子失去电子后变成钠离子 | B. | 氯离子失去电子后不能变成氯原子 | ||
| C. | 原子的质量主要集中在原子核上 | D. | 化学变化中原子不能再分 |
分析 根据电子带负电,原子失去电子变为阳离子,原子得到电子变为阳离子,电子的质量很小,可忽略不计,则质量主要集中在原子核上;原子是化学变化中的最小微粒.
解答 解:A、钠原子(Na)的最外层只有一个电子,失去后变为钠离子(Na+),说法正确;
B、氯原子(Cl)最外层有7个电子,得到一个电子后,变为氯离子(Cl-),氯离子再失去这个电子又变为氯原子(Cl),说法错误;
C、原子中电子的质量很小,可以忽略不计,原子的质量主要集中在原子核上,说法正确;
D、化学变化的实质是分子分解成原子,原子再重新组合成新的分子或直接构成物质,说法正确;
故选B.
点评 本题较简单,考查学生的基础知识,但易错选B,认为离子不能失去电子,而原子就可以得失电子变为离子,实际上离子也可以再失去或得到电子变回原子.

练习册系列答案
相关题目
9.某课外兴趣小组的同学设计了如下三个实验来验证质量守恒定律:
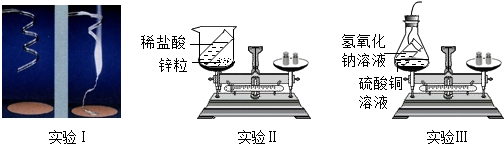
【提出假设】物质发生化学反应前后,其总质量相等(或不变)
【实验验证】
实验I:称量镁条,在空气中点燃,待反应结束后,将生成物全部收回再称量
实验II:将装有稀盐酸的小试管放入装有锌粒的烧杯中,称量,然后将盐酸与锌粒接触,过一会在称量.
实验III:将装有氢氧化钠溶液的试管放入盛有硫酸铜的锥形瓶中,并在锥形瓶口塞上橡皮塞,称量,然后设法将两种溶液接触,过一会再称量.
数据见下表:
(1)在实验I中,反应后的质量比反应前明显增加,请用质量守恒定律加以解释根据质量守恒定律,参加反应的镁带和氧气的质量总和,等于反应后生成的氧化镁的质量,由于空气中的氧气参与了反应,因此,生成氧化镁的质量比原来镁带的质量增加了
(2)实验II中出现的现象是锌粒逐渐溶解,并有气泡冒出
(3)实验III的化学方程式是2NaOH+CuSO4═Na2SO4+Cu(OH)2↓
(4)这三个实验中,实验III正确反映了反应物与生成物之间的质量关系.请从分子、原子的角度解释反应前后质量相等的原因化学反应前后原子的种类、数目和质量没有发生改变
(5)实验I、II不能正确反映反应物和生成物之间的质量关系,选一例说明实验设计中的不当之处,并提出改进思路实验I应将镁条放在密闭的金属容器中引燃,再称量.

【提出假设】物质发生化学反应前后,其总质量相等(或不变)
【实验验证】
实验I:称量镁条,在空气中点燃,待反应结束后,将生成物全部收回再称量
实验II:将装有稀盐酸的小试管放入装有锌粒的烧杯中,称量,然后将盐酸与锌粒接触,过一会在称量.
实验III:将装有氢氧化钠溶液的试管放入盛有硫酸铜的锥形瓶中,并在锥形瓶口塞上橡皮塞,称量,然后设法将两种溶液接触,过一会再称量.
数据见下表:
| 编号 | 实验I | 实验II | 实验III |
| 反应前/g | 4.8 | 112.6 | 118.4 |
| 反应后/g | 8.0 | 112.4 | 118.4 |
(2)实验II中出现的现象是锌粒逐渐溶解,并有气泡冒出
(3)实验III的化学方程式是2NaOH+CuSO4═Na2SO4+Cu(OH)2↓
(4)这三个实验中,实验III正确反映了反应物与生成物之间的质量关系.请从分子、原子的角度解释反应前后质量相等的原因化学反应前后原子的种类、数目和质量没有发生改变
(5)实验I、II不能正确反映反应物和生成物之间的质量关系,选一例说明实验设计中的不当之处,并提出改进思路实验I应将镁条放在密闭的金属容器中引燃,再称量.
8.钱江晚报报道浙江沿海地区“碘过量”.食物中碘过量易引起有患甲状腺疾病,眼球突出,脖子粗大,身体消瘦.因此呼吁大家再也不能吃加碘盐了.某兴趣小组就沿海地区甲状腺疾病患者明显增多的现象,开展了“沿海地区城镇居民甲状腺肿瘤流行病学调查”,提出“浙江沿海地区食盐中是否有必要加碘值得关注”.
如图是浙江某沿海城市1389名城镇居民甲状腺检查结果

(2)碘是合成甲状腺激素的重要原料之一.加碘食盐中的碘,是指:B;
A.碘原子 B.碘元素 C.含碘的化合物 D.含碘的单质
(3)上表为某品牌食盐的产品说明,其中“含碘量(35±15)mg/kg”符合国家食盐含碘量的标准.以含碘量35毫克/千克为标准,食盐厂家应该在1千克食盐中加入59毫克碘酸钾.(结果取整数)
(4)“碘是一把双刃剑”,碘过量也会引起甲状腺疾病.初中生每天碘元素适宜摄入量约为0.15毫克,假设碘元素全部来自“加碘盐”,你一天最多可以摄入含碘量为35毫克/千克的食盐克?(结果保留一位小数)
如图是浙江某沿海城市1389名城镇居民甲状腺检查结果

(2)碘是合成甲状腺激素的重要原料之一.加碘食盐中的碘,是指:B;
A.碘原子 B.碘元素 C.含碘的化合物 D.含碘的单质
| 产品标准号 | GB5461-2000 |
| 配料 | 精制食盐(NaCl) 碘酸钾(KIO3) |
| 质量等级 | 一级 |
| 含碘量 | (35±15)mg/kg |
| 食用方法 | 待食品熟后加入碘盐 |
| 储藏方法 | 密封保存、防潮防热 |
| 分装日期 | 见封口 |
(4)“碘是一把双刃剑”,碘过量也会引起甲状腺疾病.初中生每天碘元素适宜摄入量约为0.15毫克,假设碘元素全部来自“加碘盐”,你一天最多可以摄入含碘量为35毫克/千克的食盐克?(结果保留一位小数)
15.下列元素按原子序数由低到高的是( )
| A. | H O N | B. | Fe Cu Al | C. | Na Mg K | D. | S P C |
12.下列人类活动有利于淡水资源的利用和保护的是( )
| A. | 工业三废的任意排放 | B. | 植树造林,修建水库 | ||
| C. | 农药和化肥的广泛使用 | D. | 生活垃圾和污水的任意倾倒 |
9.根据下列四种粒子的结构示意图所获取的信息正确的是( )


| A. | 它们都表示原子 | B. | ①④表示阳离子 | ||
| C. | ④表示的是非金属元素 | D. | ②是一种不稳定结构 |

 化学研究小组为测定某石灰石样品中碳酸钙的质量分数,取100g石灰石样品放在烧杯中,然后向其中逐滴加入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参加反应).随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图所示.请完成下列计算内容:
化学研究小组为测定某石灰石样品中碳酸钙的质量分数,取100g石灰石样品放在烧杯中,然后向其中逐滴加入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参加反应).随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图所示.请完成下列计算内容: