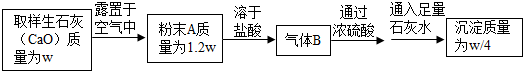
题目内容
11.在一烧杯内盛有22.3gNa2CO3和NaCl的固体混合物加入143.1g水完全溶解,向其中滴加溶质质量分数为10%的稀盐酸至不再产生气泡为止,共收集到4.4g气体.使计算:(1)原混合物中的Na2CO3质量;
(2)恰好完全反应时所消耗的稀盐酸质量;
(3)恰好反应后所得溶液的溶质质量分数.
分析 根据化学方程式,得出各物质之间的质量比,列出比例式,即可计算出参与反应的碳酸钠的质量、反应生成的氯化钠的质量和恰好完全反应时所消耗的稀盐酸质量,然后根据反应生成的氯化钠的质量+混合物中氯化钠的质量=不饱和溶液中溶质质量,混合物质量+稀盐酸质量-生成气体质量=不饱和溶液的质量,再根据溶质质量分数公式计算即可
解答 解:设参与反应的碳酸钠的质量为x,反应生成的氯化钠的质量为y,恰好完全反应时所消耗的稀盐酸质量为z
Na2CO3+2HCl=2NaCl+CO2↑+H2O.
106 73 117 44
x z×10% y 4.4g
∴$\frac{106}{x}$=$\frac{73}{z×10%}$=$\frac{117}{y}$=$\frac{44}{4.4g}$
解得:x=10.6g,y=11.7g,z=73g
烧杯里不饱和溶液中溶质总质量为:11.7g+(22.3g-10.6g)=23.4g,
烧杯里不饱和溶液的质量为:22.3g+143.1g+73g-4.4g=234g,
所得不饱和溶液的溶质质量分数:$\frac{23.4g}{234g}$×100%=10%.
答:(1)原混合物中的Na2CO3质量为10.6g;
(2)恰好完全反应时所消耗的稀盐酸质量73g;
(3)恰好反应后所得溶液的溶质质量分数为10%.
点评 本题考查学生对碳酸钠的检验方法的理解与掌握,同时考查了学生依据方程式进行计算的能力,知识综合,能较好的考查出学生对知识的掌握和应用能力.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
2.下列数据是一些物质的 pH,其中呈碱性的是( )
| A. | 液体肥皂:9~11 | B. | 西瓜汁 5~6 | C. | 酱油 4~5 | D. | 柠檬2~3 |
6.以下各组物质按照混合物、化合物、单质顺序排列的是( )
| A. | 火碱 纯碱 汞 | B. | 石油 煤 天然气 | ||
| C. | 冰水共存物 干冰 氮气 | D. | 洁净的空气 氯化氢 液氧 |
3.下列物质中属于金属材料的是( )
| A. | 石头 | B. | 竹筷 | C. | 塑料袋 | D. | 金戒指 |
20.下列应用的反应原理(用化学方程式表示)及其基本反应类型均正确的是( )
| A. | 用赤铁矿高炉炼铁Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 置换反应 | |
| B. | 硫酸厂污水可用熟石灰中和处理H2SO4+Ca(OH)2=CaSO4+H2O 复分解反应 | |
| C. | 加热混有二氧化锰的氯酸钾制取氧气2KC1O3$\frac{\underline{\;MnO_{2}\;}}{△}$2KC1+3O2↑ 分解反应 | |
| D. | 用红磷测定空气中氧气含量 4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5氧化反应 |
1.已知一定温度下硫酸铜受热分解生成氧化铜、三氧化硫、二氧化硫和氧气;SO2、SO3都能被氢氧化钠溶液吸收.现如下实验:①加热10g硫酸铜粉末至完全分解,②将生成的气体通入足量的浓的氢氧化钠溶液.反应结束后称量①中固体质量变为5g,②中溶液增加了4.5g.该实验中硫酸铜分解的化学方程式是( )
| A. | 3 CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$ 3CuO+SO3↑+2 SO2↑+O2↑ | |
| B. | 4 CuSO4 $\frac{\underline{\;\;△\;\;}}{\;}$4CuO+2 SO3↑+2 SO2↑+O2↑ | |
| C. | 5 CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$ 5CuO+SO3↑+4 SO2↑+2 O2↑ | |
| D. | 6CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$ 6CuO+4 SO3↑+2 SO2↑+O2↑ |