题目内容
17.21世纪是钛的世纪.如图1是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程: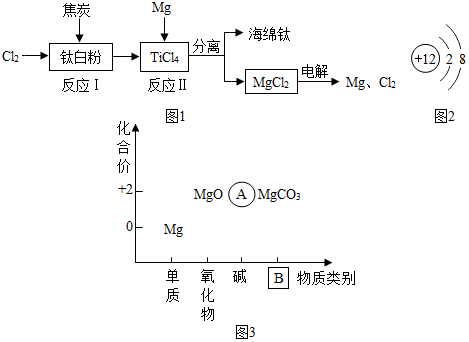
(1)反应Ⅰ在800~900℃的条件下进行,还生成一种可燃性无色气体,该反应的化学方程式为2Cl2+TiO2+2C$\frac{\underline{\;高温\;}}{\;}$ TiCl4+2CO.
(2)回答下列问题:①如图2为镁元素的某种粒子结构示意图,该图表示C(填序号).
A.分子 B.原子 C.阳离子 D.阴离子
①镁原子在化学反应中容易失去电子,镁是一种活泼(填“活泼”或“不活泼”)金属.除了能与氧气反应,还可以与氮气、二氧化碳等反应.
②已知氮化镁中氮元素的化合价为-3价,氮 化镁的化学式为Mg3N2.
③以化合价为纵坐标,以物质的类别为横坐标所绘制的图象叫价类图.如图3为镁的价类图,请分析该图后填写:A处的化学式为Mg(OH)2,B处的物质类别是盐.
(3)可获得海绵钛,化学方程式表示为TiCl4+2Mg$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2.该反应在下列哪种环境中进行A(填序号).
A.稀有气体中 B.空气中 C.氮气中 D.CO2气体中
(4)该工艺流程中,可以循环使用的物质有镁、氯气.
(5)反应Ⅱ可通过如下反应制得:TiCl4+2Mg$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2.若要制得24g钛,需要镁的质量是24克?
分析 (1)根据氯气、碳、钛白粉在高温的条件下生成四氯化钛和一氧化碳进行分析;
(2)①根据镁离子的结构示意图,说明镁是一种活泼金属,易失去电子进行分析;
②根据化合价代数和为0的原则判断;
③根据A为碱,B为盐进行分析;
(3)根据镁易与氧气、二氧化碳以及氮气反应的角度判断;
(4)根据电解氯化镁生成镁和氯气,可循环使用;
(5)根据方程式列式计算.
解答 解:(1)氯气、碳、钛白粉在高温的条件下生成四氯化钛和一氧化碳,化学方程式为:2Cl2+TiO2+2C$\frac{\underline{\;高温\;}}{\;}$ TiCl4+2CO;
(2)①由镁离子的结构示意图,说明镁是一种活泼金属,易失去电子,故选:C;
②已知氮化镁中氮元素的化合价为-3价,镁为+2价,则氮化镁的化学式为Mg3N2;
③由图象可知A为碱,即Mg(OH)2,B为盐;
(3)镁易与氧气、二氧化碳以及氮气反应,应在惰性气体中反应,故选:A;
(4)电解氯化镁生成镁和氯气,可循环使用;
(5)设需要镁的质量为x
TiCl4+2Mg$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2,
48 48
x 24g
$\frac{48}{x}$=$\frac{48}{24g}$
x=24g
故答案为:(1)2Cl2+TiO2+2C$\frac{\underline{\;高温\;}}{\;}$ TiCl4+2CO;
(2)①C;
②Mg3N2;
③Mg(OH)2,盐;
(3)A;
(4)镁,氯气;
(5)24g.
点评 本题综合考查物质的分离、提纯,为高频考点,侧重学生的分析能力和实验能力的考查,注意把握反应的流程以及相关物质的性质,难度不大.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
7.合金的用途十分广泛.某化学小组欲测定黄铜片(铜锌合金)的组成进行如下实验:取黄铜片30g放入烧杯,将250g稀硫酸分5次加入烧杯中,充分反应后,测得剩余固体的质量记录如下.请计算:
(1)黄铜片中铜的含量.
(2)稀硫酸中溶质的质量分数.
| 次 数 | 1 | 2 | 3 | 4 | 5 |
| 加入稀硫酸质量/g | 50 | 50 | 50 | 50 | 50 |
| 剩余固体质量/g | 23.5 | 17 | 10.5 | 9.6 | 9.6 |
(2)稀硫酸中溶质的质量分数.
2.如图图示实验操作中,正确的是( )
| A. |  | B. |  | C. |  | D. |  |
 如图所示是一瓶用排水法收集好的无色气体.据此,(除无色外)请你写出与这种气体相关的物理性质.
如图所示是一瓶用排水法收集好的无色气体.据此,(除无色外)请你写出与这种气体相关的物理性质.


