题目内容
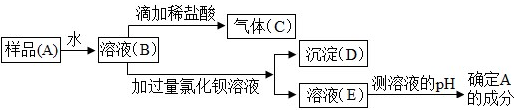
4.2014年3月22日是第22届“世界水日”,请你根据所学,回答下列问题.(1)图1是简易净水装置.该净水装置不能(填“能”或“不能”)将河水变成纯水.
(2)二氧化氯(ClO2)是新一代饮用水的消毒剂,工业上将氯气
(Cl2)通入亚氯酸钠(NaClO2)溶液中反应来制取二氧化氯,同时生成氯化钠.写出该反应的化学方程式:Cl2+2NaClO2═2ClO2+2NaCl.
(3)小丽收集到一瓶浑浊的河水,她要模拟自来水厂的净水过程,最终制成蒸馏水,过程如图2所示.

操作①的名称是过滤;操作②应选用的装置是图3中的(Ⅱ)(填序号,下同);操作③应选用的装置是图3中的(Ⅰ).

(4)小丽取少量液体D于试管中,加入少量肥皂水,振荡,发现有较多浮渣产生,说明液体D是硬水.(填“硬”或“软”)
分析 (1)根据简易净水装置图,小卵石、石英砂、蓬松棉可以把不溶于水的物质除去,活性炭可除去水中的色素、异味等,据此分析解答即可;
(2)根据参加反应的物质及生成的物质,完成反应化学方程式的书写;
(3)过滤是分离可溶性物质与不溶性物质的方法;分析流程图可知:操作②除去了液体C中的异味、色素,说明该操作中应用了具有吸附作用的物质,如活性炭;操作③可得到纯水,说明进行了蒸馏操作;
(4)根据检验硬水、软水的方法分析解答;
解答 解:(1)根据净水简易装置图,可知水经过小卵石可除去较大颗粒的固体不溶物,而石英砂、蓬松棉则可除去小颗粒的固体不溶物,因此小卵石、石英砂都起到过滤的作用;活性炭可除去水中的色素、异味等,经过该装置的水并不能减少其中钙、镁离子,因此不能将硬水软化;
(2)由氯气在溶液中与亚氯酸钠反应生成二氧化氯和氯化钠可知:该化学方程式为Cl2 +2NaClO2 =2NaCl+2ClO2;
(3)过滤是分离可溶性物质与不溶性物质的方法;分析流程图可知:操作①将固体和液体分开,说明采取了过滤操作,操作②除去了液体C中的异味、色素,说明该操作中应用了具有吸附作用的物质,如活性炭;操作③可得到纯水,说明进行了蒸馏操作;
(4)硬水中若加入少量肥皂水,振荡,会有较多浮渣产生;
答案:
(1)不能;
(2)Cl2+2NaClO2═2ClO2+2 NaCl;
(3)过滤; (Ⅱ);(Ⅰ);
(4)硬.
点评 本题涉及硬水和软水的检验、净化及化学方程式的书写等基础知识,题目难度不大但涉及面较广,耐心审题、沉着作答是解题的关键.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
14. 今年5月12日是我国第八个“防灾减灾日”,主题是“减少灾害风险 建设安全城市”.下列做法不合理的是( )
今年5月12日是我国第八个“防灾减灾日”,主题是“减少灾害风险 建设安全城市”.下列做法不合理的是( )
 今年5月12日是我国第八个“防灾减灾日”,主题是“减少灾害风险 建设安全城市”.下列做法不合理的是( )
今年5月12日是我国第八个“防灾减灾日”,主题是“减少灾害风险 建设安全城市”.下列做法不合理的是( )| A. | 扑灭森林火灾,可将大火蔓延路线前的一片树木砍掉,形成隔离带 | |
| B. | 室内电器着火,先切断电源,再用灭火器灭火 | |
| C. | 把燃气热水器安装在浴室内 | |
| D. | 油库、面粉加工厂、纺织厂等场所要严禁烟火 |
15.下列图象不能 正确反映其对应变化关系的是( )
| A. |  加热一定质量的高锰酸钾制取氧气 | |
| B. |  向等质量的铝粉和镁粉中分别滴入质量分数相同的足量的稀盐酸 | |
| C. |  氢气和过量的氧气在密闭容器中完全反应 | |
| D. |  向一定质量的氯化铁和稀盐酸的混合溶液中逐滴滴加氢氧化钠溶液 |
19. 如图是从元素周期表第Ⅶ主族截取的局部图,图中的四种元素影响着我们的生活.下面是根据图示信息的一些说法,其中错误的是( )
如图是从元素周期表第Ⅶ主族截取的局部图,图中的四种元素影响着我们的生活.下面是根据图示信息的一些说法,其中错误的是( )
 如图是从元素周期表第Ⅶ主族截取的局部图,图中的四种元素影响着我们的生活.下面是根据图示信息的一些说法,其中错误的是( )
如图是从元素周期表第Ⅶ主族截取的局部图,图中的四种元素影响着我们的生活.下面是根据图示信息的一些说法,其中错误的是( )| A. | 这四种元素都属于非金属元素 | B. | 这四种元素具有相似的化学性质 | ||
| C. | 1个氯原子的质量约是35.45g | D. | 氟原子核外电子数为9 |
16.下列除去杂质的方法中,正确的是( )
| 选项 | 物质 | 少量杂质 | 除杂质的方法 |
| A | K2CO3溶液 | KCl | 加适量稀盐酸 |
| B | CaCl2溶液 | HCl | 加过量碳酸钙,过滤 |
| C | KCl固体 | MnO2 | 加水溶解,过滤 |
| D | CO2 | CO | 点燃 |
| A. | A | B. | B | C. | C | D. | D |
13.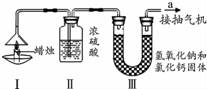 为了测定蜡烛中碳、氢两种元素的质量比,某化学兴趣小组设计了如下图所示的实验.实验步骤如下:先分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量.按图示连接好仪器装置,点燃蜡烛,同时从a导管抽气.一段时间后熄灭蜡烛,再分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量.(提示:浓硫酸只吸收水,氢氧化钠和氯化钙固体即可以吸收水分也可以吸收二氧化碳)实验数据如表.
为了测定蜡烛中碳、氢两种元素的质量比,某化学兴趣小组设计了如下图所示的实验.实验步骤如下:先分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量.按图示连接好仪器装置,点燃蜡烛,同时从a导管抽气.一段时间后熄灭蜡烛,再分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量.(提示:浓硫酸只吸收水,氢氧化钠和氯化钙固体即可以吸收水分也可以吸收二氧化碳)实验数据如表.
(1)该实验中测得水的质量为1.8g,二氧化碳的质量为4.4g.
(2)由该实验数据计算,蜡烛中碳、氢元素的质量之比为6:1
(3)理论上,装置Ⅱ和装置Ⅲ增加的总质量大于蜡烛失去的质量,其原因是蜡烛燃烧时,氧气也参与反应,故理论上,装置II和III增加的质量等于消耗的蜡烛和氧气的总质量.
(4)该实验能否准确测出蜡烛燃烧生成二氧化碳和水的质量?不能(填“能”或“不能”),理由是空气中的水和二氧化碳也能被装置Ⅱ、装置Ⅲ吸收.
 为了测定蜡烛中碳、氢两种元素的质量比,某化学兴趣小组设计了如下图所示的实验.实验步骤如下:先分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量.按图示连接好仪器装置,点燃蜡烛,同时从a导管抽气.一段时间后熄灭蜡烛,再分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量.(提示:浓硫酸只吸收水,氢氧化钠和氯化钙固体即可以吸收水分也可以吸收二氧化碳)实验数据如表.
为了测定蜡烛中碳、氢两种元素的质量比,某化学兴趣小组设计了如下图所示的实验.实验步骤如下:先分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量.按图示连接好仪器装置,点燃蜡烛,同时从a导管抽气.一段时间后熄灭蜡烛,再分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量.(提示:浓硫酸只吸收水,氢氧化钠和氯化钙固体即可以吸收水分也可以吸收二氧化碳)实验数据如表.| 蜡烛 | 装置Ⅱ | 装置Ⅲ | |
| 反应前的质量/g | 15.8 | 182.3 | 212.2 |
| 反应后的质量/g | 14.4 | 184.1 | 216. |
(2)由该实验数据计算,蜡烛中碳、氢元素的质量之比为6:1
(3)理论上,装置Ⅱ和装置Ⅲ增加的总质量大于蜡烛失去的质量,其原因是蜡烛燃烧时,氧气也参与反应,故理论上,装置II和III增加的质量等于消耗的蜡烛和氧气的总质量.
(4)该实验能否准确测出蜡烛燃烧生成二氧化碳和水的质量?不能(填“能”或“不能”),理由是空气中的水和二氧化碳也能被装置Ⅱ、装置Ⅲ吸收.
 A、B、C、D、E是初中化学常见的物质,相关关系如图所示,其中A是铁锈的主要成分Fe2O3,B是一种金属单质,
A、B、C、D、E是初中化学常见的物质,相关关系如图所示,其中A是铁锈的主要成分Fe2O3,B是一种金属单质,