题目内容
19.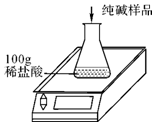 侯氏制碱法得到的纯碱产品中常含有少量氯化钠杂质.实验中取30g纯碱样品,平均分成五等份(每等分6克)依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为60g),每次充分反应后都进行称量,得到的实验数据如下表(假设反应产生气体全部逸出,其它物质的挥发忽略不计):
侯氏制碱法得到的纯碱产品中常含有少量氯化钠杂质.实验中取30g纯碱样品,平均分成五等份(每等分6克)依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为60g),每次充分反应后都进行称量,得到的实验数据如下表(假设反应产生气体全部逸出,其它物质的挥发忽略不计):| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 加入纯碱样品的质量/g | 6 | 6 | 6 | 6 | 6 |
| 电子天平的示数/g | 163.8 | 167.6 | 171.4 | 177.4 | 183.4 |
(2)列式计算纯碱样品中碳酸钠的质量分数 (计算结果精确到0.1%).
分析 数据处理如下,这样很直观看出反应情况
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 加入纯碱样品的质量/g | 6 | 6 | 6 | 6 | 6 |
| 反应前质量/g | 166 | 169.8 | 173.6 | 177.4 | 183.4 |
| 电子天平的示数/g | 163.8 | 167.6 | 171.4 | 177.4 | 183.4 |
| 质量变化 | 2.2 | 2.2 | 2.2 | 0 | 0 |
根据6g碳酸钠样品对应2.2g二氧化碳求算样品中碳酸钠的质量分数.
解答 解:数据处理如下,
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 加入纯碱样品的质量/g | 6 | 6 | 6 | 6 | 6 |
| 反应前质量/g | 166 | 169.8 | 173.6 | 177.4 | 183.4 |
| 电子天平的示数/g | 163.8 | 167.6 | 171.4 | 177.4 | 183.4 |
| 质量变化 | 2.2 | 2.2 | 2.2 | 0 | 0 |
6g碳酸钠样品对应2.2g二氧化碳求算样品中碳酸钠的质量分数
设纯碱样品中碳酸钠的质量分数为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
5gx 2.2g
$\frac{106}{44}$=$\frac{5gx}{2.2g}$
x≈88.3%
答:(1)发生.
(2)纯碱样品中碳酸钠的质量分数约为88.3%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
7.西湖龙井茶全国有名,为保持茶叶的品质,要做到防潮和防氧化.为此在茶叶的包装袋内往往放入一小包黑色的“双吸剂”.下列可作为“双吸剂”的 是( )
| A. | 碳粉 | B. | 碱石灰 | C. | 铁粉 | D. | 二氧化锰 |
4.实验小组研究盐酸、氢氧化钙两种物质的化学性质,做了如图所示几个实验.得知:Na2CO3溶液和澄清石灰水都呈碱性(pH>7),CaCl2溶液呈中性(pH=7).
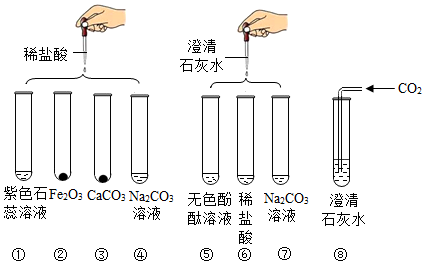
(1)实验后某试管中为黄色溶液,该试管中发生反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O.
(2)实验后某试管中为红色溶液,向其中加入足量的稀盐酸,溶液变为无色.由此推断,该试管中最初盛有的物质是无色酚酞试液.
(3)实验后某试管的底部有白色固体,过滤后向滤液中滴加稀盐酸,一段时间后有气泡出现.由此推断,该试管中最初发生反应的化学方程为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
(4)实验某试管中只得到无色溶液,向其中加入足量的Na2CO3溶液,无明显现象.由此推断,该试管中最初发生反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑,其反应类型为复分解反应.
(5)实验结束后,某同学将⑤⑥⑦三个试管的废液倒入同一个烧杯中,观察到废液呈浑浊并显红色,由此分析可知:
①废液中除碳酸钙、氯化钠、水和指示剂外,一定还含有氢氧化钠.
②依据上述实验过程,你认为引起废液呈碱性的物质组成共有3种可能.
③为了进一步探究废液的成分,该同学进行以下实验:

(1)实验后某试管中为黄色溶液,该试管中发生反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O.
(2)实验后某试管中为红色溶液,向其中加入足量的稀盐酸,溶液变为无色.由此推断,该试管中最初盛有的物质是无色酚酞试液.
(3)实验后某试管的底部有白色固体,过滤后向滤液中滴加稀盐酸,一段时间后有气泡出现.由此推断,该试管中最初发生反应的化学方程为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
(4)实验某试管中只得到无色溶液,向其中加入足量的Na2CO3溶液,无明显现象.由此推断,该试管中最初发生反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑,其反应类型为复分解反应.
(5)实验结束后,某同学将⑤⑥⑦三个试管的废液倒入同一个烧杯中,观察到废液呈浑浊并显红色,由此分析可知:
①废液中除碳酸钙、氯化钠、水和指示剂外,一定还含有氢氧化钠.
②依据上述实验过程,你认为引起废液呈碱性的物质组成共有3种可能.
③为了进一步探究废液的成分,该同学进行以下实验:
| 步骤 | 操作 | 现象 | 结论 |
| 第一步 | 取样,加入少量盐酸 | 无气泡产生 | 废液中一定没有碳酸钠 |
| 第二步 | 再次取样,进行实验⑧ | 无白色沉淀产生 | 废液中只有氢氧化钠 |
9.下列应用及相应的原理(用化学方程式表示)都正确的是( )
| A. | 用小苏打治疗胃酸过多 NaCO3+2HCl═2NaCl+H2O+CO2↑ | |
| B. | 实验室用过氧化氢溶液制取氧气 2H2O2═2H2O+O2↑ | |
| C. | 用石灰水检验二氧化碳 Ca(OH)2+CO2=CaCO3+H2O | |
| D. | 用盐酸除去铁锈 Fe2O3+6HCl=2FeCl3+3H2O |
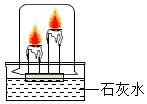 如图,在浮于石灰水上的木块上有一高一矮两支蜡烛,点燃后罩上烧杯,过一会儿,两支蜡烛在没有燃烧完的情况下先后熄灭.则先熄灭的是高的蜡烛(填“高”或“矮”);此实验可观察到的现象是石灰水变浑浊.
如图,在浮于石灰水上的木块上有一高一矮两支蜡烛,点燃后罩上烧杯,过一会儿,两支蜡烛在没有燃烧完的情况下先后熄灭.则先熄灭的是高的蜡烛(填“高”或“矮”);此实验可观察到的现象是石灰水变浑浊.