题目内容
9.下列做法不正确的是( )| A. | 冬天取暖时,室内放一定量的水可以防煤气中毒 | |
| B. | 高温下,利用一氧化碳把铁从铁矿石中还原出来 | |
| C. | 废旧纸张、易拉罐和塑料瓶放入可回收垃圾箱 | |
| D. | 过滤时,用玻璃棒引流 |
分析 A、煤气的主要成分是一氧化碳,不能溶于水;
B、根据一氧化碳具有还原性分析;
C、废旧纸张、易拉罐和塑料瓶都可以回收利用;
D、根据过滤的注意事项分析.
解答 解:A、煤气的主要成分是一氧化碳,不能溶于水,故做法错误;
B、一氧化碳具有还原性,高温下,可以利用一氧化碳把铁从铁矿石中还原出来,故做法正确;
C、废旧纸张、易拉罐和塑料瓶都可以回收利用,放入可回收垃圾箱,故做法正确;
D、为防止液体溅出,过滤时,要用玻璃棒引流,故做法正确.
故选:A.
点评 根据过滤实验的正确操作、一氧化碳的性质、可回收垃圾等知识分析解答.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
7.仅通过下列操作就能达到提纯目的是(括号内为杂质)( )
| A. | CaO(CaCO3):放入适量稀盐酸 | B. | H2(HCl):通过足量氢氧化钠溶液 | ||
| C. | N2(O2):通过足量红热的木炭 | D. | CO2(CO):通过足量灼热氧化铜 |
14.空气中含量较多,可用作焊接金属保护气的是( )
| A. | 氧气 | B. | 二氧化碳 | C. | 稀有气体 | D. | 氢气 |
1.推理是化学学习中常用的推理方法,下列推理正确的是( )
| A. | 置换反应的生成物为单质和化合物,则有单质和化合物生成的反应一定为置换反应 | |
| B. | 铝表面的氧化铝薄膜能起到保护作用,则铁表面的氧化铁也能起到保护作用 | |
| C. | Na+、Mg2+、Cl+的最外层电子数均为8,由此得出离子的最外层电子数均为8 | |
| D. | 稀盐酸、稀硫酸能使紫色石蕊试液变红,则醋酸也能使紫色石蕊试液变红色 |
18.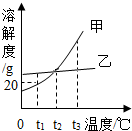 根据如图的溶解度曲线,判断下列说法不正确的是( )
根据如图的溶解度曲线,判断下列说法不正确的是( )
 根据如图的溶解度曲线,判断下列说法不正确的是( )
根据如图的溶解度曲线,判断下列说法不正确的是( )| A. | 甲物质的溶解度随温度的升高而增大 | |
| B. | t1℃时甲物质的饱和溶液中溶质质量分数为20% | |
| C. | 将t2℃时乙物质的饱和溶液降到t1℃,有晶体析出 | |
| D. | t3℃时甲物质的溶解度大于t2℃时乙物质的溶解度 |
19.实验室有一瓶长期露置于空气中的氢氧化钠溶液,确认已变质.某学习小组展开如下探究,确定该溶液的成分,并进一步从变质的溶液中回收氢氧化钠.
【问题1】久置的氢氧化钠溶液是全部变质?还是部分变质?
【探究1】确定该溶液中溶质的成分.
【反思】氢氧化钠溶液变质的原因2NaOH+CO2=Na2CO3+H2O(用化学方程式表示),因此氢氧化钠溶液必须密封保存.
【问题2】如何从变质的氢氧化钠溶液中回收得到较纯净的氢氧化钠固体.
【探究2】回收纯净的氢氧化钠固体.(已知:氢氧化钠溶解度随温度升高增大明显)
请回答下列问题:
(1)试剂X是Ca(OH)2,系列操作z中步骤②的名称是过滤.
(2)探究1中的物质检验和探究2中的除杂提纯都将碳酸钠进行了转化,但二者目的不同,请说明.实验探究1中将碳酸钠转化为氯化钠目的是排除对氢氧化钠检验的干扰实验探究2除杂是为了除去产品中的杂质而将碳酸钠转化为产品氢氧化钠.
【问题1】久置的氢氧化钠溶液是全部变质?还是部分变质?
【探究1】确定该溶液中溶质的成分.
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量溶液于试管中,向溶液中滴加 过量的氯化钙(合理即可)溶液,并不断振荡. | 白色沉淀产生 | 该溶液部分变质,含有 碳酸钠和氢氧化钠. |
| (2)将步骤(1)反应后的混合物静置,取少量上层清液,滴加2~3滴酚酞试液. | 溶液变红色 |
【问题2】如何从变质的氢氧化钠溶液中回收得到较纯净的氢氧化钠固体.
【探究2】回收纯净的氢氧化钠固体.(已知:氢氧化钠溶解度随温度升高增大明显)

请回答下列问题:
(1)试剂X是Ca(OH)2,系列操作z中步骤②的名称是过滤.
(2)探究1中的物质检验和探究2中的除杂提纯都将碳酸钠进行了转化,但二者目的不同,请说明.实验探究1中将碳酸钠转化为氯化钠目的是排除对氢氧化钠检验的干扰实验探究2除杂是为了除去产品中的杂质而将碳酸钠转化为产品氢氧化钠.
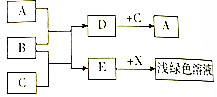 已知A、B、C、D、E为初中常见物质,B为红棕色固体,它们之间存在如图转化关系:(图中“→”表示物质间存在的转化关系,部分产物已略去)
已知A、B、C、D、E为初中常见物质,B为红棕色固体,它们之间存在如图转化关系:(图中“→”表示物质间存在的转化关系,部分产物已略去) 用木炭还原氧化铜的实验,如图所示:
用木炭还原氧化铜的实验,如图所示: